Tin tức
Giá trị của các dấu ấn sinh học trong chẩn đoán, theo dõi và tiên lượng ung thư biểu mô tế bào gan (HCC)
- 19/07/2020 | Ung thư gan: nguyên nhân, triệu chứng, đối tượng nguy cơ
- 29/03/2020 | Xét nghiệm AFP giúp tầm soát ung thư gan mà bạn nhất định phải biết
- 23/06/2020 | Chẩn đoán ung thư gan bằng phương pháp chụp cắt lớp gan
- 07/09/2020 | Ý nghĩa của xét nghiệm tầm soát ung thư gan trong khám chữa bệnh
Tóm tắt
1) Trên thế giới, ung thư biểu mô tế bào gan (HCC) là loại ung thư phổ biến thứ 5 và là nguyên nhân phổ biến thứ 3 gây tử vong do ung thư vào năm 2018. Các yếu tố nguy cơ đối với HCC gồm viêm gan B và viêm gan C mạn, nghiện rượu, các bệnh gan chuyển hóa (đặc biệt là bệnh gan nhiễm mỡ không do rượu) và sự tiếp xúc với các chất độc trong chế độ ăn uống như aflatoxin và axit aristolochic.
2) Hơn 60% bệnh nhân được chẩn đoán mắc ung thư biểu mô tế bào gan giai đoạn muộn sau khi đã di căn, dẫn đến tỷ lệ sống sót sau 5 năm nói chung chỉ là <16%. Trái lại, những bệnh nhân được chẩn đoán bệnh ở giai đoạn sớm thì tiên lượng bệnh tương đối tốt, tỷ lệ sống 5 năm >70%. Vì vậy, việc chẩn đoán sớm HCC là rất cần thiết.
3) Các dấu ấn sinh học hiện nay có độ nhạy và độ đặc hiệu cao để phát hiện HCC bao gồm AFP, AFP-L3, DCP, sự kết hợp của 3 dấu ấn sinh học này và điểm GALAD. Trong số đó, AFP được xem là dấu ấn sinh học huyết tương hữu ích nhất cho những bệnh nhân có nguy cơ bị HCC. Tuy nhiên, độ nhạy của nó để phát hiện HCC dao động trong khoảng 25% -60% vì nồng độ AFP bình thường có ở 30% bệnh nhân bị HCC và độ đặc hiệu của nó cũng thấp vì AFP huyết tương tăng cũng có thể được thấy ở bệnh nhân xơ gan và viêm gan mạn.
4) Các dấu ấn sinh học mới có độ nhạy và độ đặc hiệu cao nhất để phát hiện HCC gồm glypican 3 (GPC3), glutamine synthase (GS), protein sốc nhiệt 70 (HSP70) (mô), cytokeratin 19 (CK19), protein Golgi 73 (GP73 ), midkine, osteopontin (OPN), kháng nguyên ung thư biểu mô tế bào vảy (SCCA), annexin A2, yếu tố tăng trưởng nguyên bào sợi 3/4 (FGF3/4), các micro-RNA (miRNA), các RNA dài không mã hóa (lncRNA), các tế bào khối u trong máu tuần hoàn (CTCs) và DNA phi tế bào (cfDNA).
5) Vì HCC là một bệnh phức tạp với nhiều cơ chế gây bệnh do nhiều yếu tố nguy cơ gây ra, nên rất khó để mô tả HCC bằng một dấu ấn sinh học duy nhất. Sự kết hợp của các dấu ấn sinh học có thể có giá trị hơn cho việc chẩn đoán, tiên lượng và theo dõi HCC. Trong tương lai gần, các dấu ấn sinh học mới để chẩn đoán sớm, tiên lượng, dự đoán đáp ứng với điều trị đích và điều trị đích của HCC sẽ là một trong những lĩnh vực nghiên cứu về các dấu ấn sinh học hứa hẹn nhất.
*
The value of biomarkers in the diagnosis, monitoring and prognosis of hepatocellular carcinoma (HCC).
Luat Nghiem Nguyen
MEDLATEC General Hospital
Abstract
1) Worldwide, hepatocellular carcinoma (HCC) was the fifth most common cancer and the third most common cause of cancer deaths in 2018. Risk factors for HCC include chronic hepatitis B and hepatitis C, alcoholism, metabolic liver diseases (especially non-alcoholic fatty liver disease) and exposure to dietary toxins such as aflatoxin and aristolochic acid.
2) More than 60% of patients are diagnosed with late-stage HCC after metastasis has occurred, resulting in an overall 5-year survival rate of <16%. In contrast, patients diagnosed with early stage disease have a relatively good prognosis, with a 5-year survival rate of >70%. So, the early diagnosis of HCC is quite essential.
3) The current markers with high sensitivity and specificity for the detection of HCC including AFP, AFP-L3, DCP, the combination of 3 these biomarkers and GALAD scores. Among them, AFP has been regarded as the most useful plasma biomarker for patients at risk for HCC. However, its sensitivity for detecting HCC ranges between 25%-60% because normal AFP levels are present in as many as 30% of patients with HCC, and its specificity is also low because plasma increased AFP can also be detected in patients with cirrhosis and chronic hepatitis.
4) The new biomarkers with highest sensitivity and specificity for the detection of HCC including glypican 3 (GPC3), glutamine synthase (GS), heat shock protein 70 (HSP70) (tissue), cytokeratin 19 (CK19), Golgi protein 73 (GP73), midkine, osteopontin (OPN), squamous cell carcinoma antigen (SCCA), annexin A2, fibroblast growth factor 3/4 (FGF3/4), micro-RNAs (miRNAs), long non-coding RNAs (lncRNAs), circulating tumor cells (CTCs) và cell-free DNA (cfDNA).
5) Because HCC is a complex disease with multiple underlying pathogenic mechanisms caused by a variety of risk factors, it is difficult to characterize HCC with a single biomarker. A combination of biomarkers may be more valuable for the diagnosis, prognosis and monitoring of HCC. In the near future, new biomarkers for early diagnosis, prognosis, predict response to therapeutic targets and as therapeutic targets of HCC will be one of the most promising fields of biomarker research.
*
Trên thế giới, ung thư biểu mô tế bào gan (hepatocellular carcinoma: HCC) là loại ung thư phổ biến thứ 5 và là nguyên nhân phổ biến thứ 3 gây tử vong do ung thư vào năm 2018, với ước tính 841.080 ca hợp mắc mới và 781.631 ca tử vong (Globocan, 2018). Các yếu tố nguy cơ đối với HCC gồm viêm gan B và viêm gan C mạn, nghiện rượu, bệnh gan chuyển hóa (đặc biệt là bệnh gan nhiễm mỡ không do rượu) và tiếp xúc với các chất độc trong chế độ ăn uống như aflatoxin và axit aristolochic. Tất cả các yếu tố nguy cơ này đều có thể phòng ngừa được, cho thấy tiềm năng đáng kể của việc phòng ngừa nguy cơ để giảm gánh nặng toàn cầu của HCC. Việc giám sát và phát hiện sớm HCC làm tăng cơ hội điều trị khỏi bệnh, tuy nhiên, việc giám sát HCC về cơ bản hiện chưa được đáp ứng đầy đủ (Yang JD, 2019 [11]). HCC giai đoạn đầu có thể được điều trị bằng cách cắt bỏ một phần gan, phẫu thuật cắt bỏ hoặc ghép gan. Việc lựa chọn phương pháp điều trị phụ thuộc vào đặc điểm của khối u, mức độ nghiêm trọng của rối loạn chức năng gan tiềm ẩn, tuổi và các bệnh lý đi kèm khác. Mặc dù các dấu ấn sinh học huyết tương hoặc mô khác nhau đã được nghiên cứu, nhưng giá trị lâm sàng của chúng vẫn chưa được chấp nhận rộng rãi. Một trong những vấn đề quan trọng nhất của các dấu ấn sinh học đối với HCC là độ nhạy và độ đặc hiệu không đủ để sàng lọc và chẩn đoán sớm HCC. Tuy nhiên, phần lớn các dấu ấn sinh học này có thể giúp đánh giá tiên lượng, đáp ứng điều trị và theo dõi tái phát.
Trong bài tổng quan này, chúng tôi trình bày về giá trị của các dấu ấn sinh học cũ và mới trong chẩn đoán sớm, tiên lượng và đánh giá hiệu quả điều trị ung thư biểu mô tế bào gan.
1. Các dấu ấn sinh học cũ được sử dụng trong chẩn đoán HCC
1.1. AFP
AFP là dấu ấn sinh học cũ được sử dụng rộng rãi nhất để chẩn đoán và theo dõi HCC. AFP là một glycoprotein huyết tương. Sự tổng hợp AFP ở gan xảy ra trong thời kỳ bào thai và bị kìm hãm trong thời kỳ trưởng thành. Do đó, nồng độ AFP thường giảm nhanh sau khi sinh và duy trì ở mức thấp trong suốt tuổi trưởng thành. Một số nghiên cứu cho thấy nồng độ AFP trong huyết tương >20 ng/ mL tương quan với sự tăng nguy cơ phát triển HCC. AFP được xem là dấu ấn sinh học huyết tương hữu ích nhất cho những bệnh nhân có nguy cơ bị HCC. Điều cần chú ý là, độ nhạy của AFP để chẩn đoán HCC dao động khá rộng (khoảng 25%-60%) vì có đến 30-40% số bệnh nhân HCC nồng độ AFP huyết tương không tăng và độ đặc hiệu của nó cũng thấp vì nồng độ AFP huyết tương cũng có thể tăng ở những bệnh nhân xơ gan và viêm gan mạn. Vì vậy, để sàng lọc và phát hiện sớm HCC, việc sử dụng kết hợp AFP và siêu âm trong khoảng thời gian 3-6 tháng ở những đối tượng nguy cơ HCC cao là cần thiết. Việc sử dụng kết hợp AFP và siêu âm so với chỉ sử dụng siêu âm một mình làm tăng khả năng phát hiện HCC thêm 6%-8%. Độ nhạy và độ đặc hiệu theo giá trị cắt của AFP để chẩn đoán sớm HCC được thể hiện ở Hình 1.
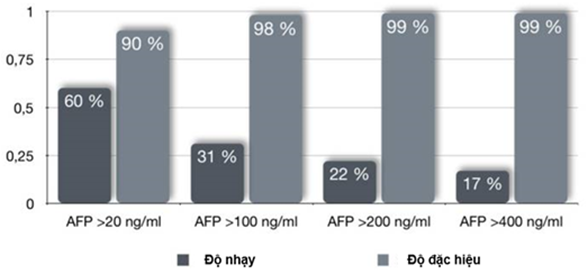
Hình 1. Độ nhạy và độ đặc hiệu theo giá trị cắt của AFP để chẩn đoán sớm HCC (Trevisani F, 2001 [8]).
Một hạn chế khác của AFP là nó ít có giá trị trong việc phân biệt ung thư biểu mô đường mật trong gan (intrahepatic cholangiocarcinoma: ICC) và HCC. Mặc dù AFP âm tính là xét nghiệm nhạy nhất để phân biệt ICC với HCC (91,1%), nhưng độ đặc hiệu của nó vẫn thấp hơn rõ rệt so với các dấu ấn sinh học khác như CA242 dương tính và CA19-9 dương tính.
1.2. Lens Alpha-Fetoprotein Culinaris Agglutin-3 (AFP-L3)
AFP toàn phần gồm ba đồng dạng, AFP-L1, AFP-L2 và AFP-L3, có thể được phát hiện dựa trên khả năng phản ứng của nó với ái lực của Lens culinaris agglutinin (LCA) trên điện di. Trong số ba dạng đồng dạng này, phần AFP-L3 đặc hiệu hơn đối với HCC vì nó chỉ được sản xuất bởi các tế bào HCC. Sự tăng trên 15% của AFP-L3% có độ nhạy tốt hơn một chút so với AFP để phát hiện HCC. Việc sử dụng đầy hứa hẹn này như một xét nghiệm giám sát đã được đề xuất từ các nghiên cứu hồi cứu, trong đó 95% và 71% bệnh nhân HCC có giá trị dương tính của AFP-L3% lần lượt là 3 và 6 tháng trước khi chẩn đoán. Tuy nhiên, trong các nghiên cứu sâu hơn, độ nhạy và độ đặc hiệu của nó thay đổi rất nhiều khi sử dụng ngưỡng tăng 10-15% (tương ứng với 36-96% và 89-94%). Điều cần chú ý là AFP-L3 luôn được đo cùng với AFP và ý nghĩa của nó phụ thuộc vào giá trị AFP. Giá trị AFP huyết tương thường được đo bằng xét nghiệm đo miễn dịch, trong khi nồng độ AFP-L3 bằng điện di ái lực lectin kết hợp với kháng thể và được biểu thị bằng tỷ lệ % của AFP-L3 trên AFP toàn phần. Ở những bệnh nhân có giá trị AFP thấp (<10 ng/ mL) và ở những bệnh nhân có giá trị AFP cao hơn (>400 ng/ mL), tỷ lệ AFP-L3 có thể không được xác định chính xác. Do đó, lợi ích lâm sàng lớn nhất của AFP-L3 là ở những bệnh nhân có giá trị AFP tăng vừa phải (20-200 ng/ mL), ở đó chúng có độ đặc hiệu cao đối với HCC (Sterling RK, 2009 [6]).
1.3. Des-γ-Carboxy Prothrombin (DCP)
Một dấu ấn huyết tương khác là Des-γ-Carboxy Prothrombin (DCP), còn được gọi là protein được cảm ứng bởi sự vắng mặt của vitamin K hoặc chất đối vận II (protein induced by vitamin K absence or antagonist II: PIVKA-II) cũng đã được sử dụng, một mình hoặc kết hợp, trong chẩn đoán và theo dõi HCC. DCP là một phân tử prothrombin bất thường được tạo ra do thiếu vitamin K và sự cacboxyl hóa sau chuyển hóa được gọi là DCP, là một phân tử prothrombin bất thường được sản xuất quá mức ở bệnh nhân HCC. Mức độ DCP huyết tương có liên quan đến sự xâm lấn tĩnh mạch cửa và giai đoạn tiến triển của HCC. Việc chẩn đoán HCC dựa trên DCP huyết tương có độ nhạy dưới mức tối ưu (48%-62%) nhưng độ đặc hiệu đạt yêu cầu (81%-98%) ở bệnh nhân HCC (Tateishi R, 2007 [7]).
Về giá trị của sự kết hợp của các dấu ấn AFP + AFP-L3 + DCP trong chẩn đoán HCC, một nghiên cứu kết hợp các dấu ấn AFP-L3, AFP và DCP trên 104 bệnh nhân HCC, 43% trong số họ có nồng độ AFP dưới 10 ng/ mL, đạt được độ nhạy 60,6% và độ đặc hiệu 100% (Marrero J, 2009 [4]. Hiện nay, sự kết hợp AFP + AFP-L3 + DCP được đưa vào thuật toán để chẩn đoán HCC theo hướng dẫn về quản lý HCC ở Châu Á, nhưng hiên chưa được áp dụng ở phương Tây.
Theo Choi JY et al, 2013 [3], sự kết hợp 3 dấu ấn khối u này có khả năng phát hiện sớm 81,8% HCC ở giai đoạn sớm (giai đoạn I), 86,7% khối u có kích thước nhỏ (<2 cm) và 91,7% một khối u đơn lẻ của HCC ở mức độ AFP thấp <20 ng/mL (Bảng 1).
Bảng 1. Độ nhạy của AFP-L3 và DCP theo đặc điểm khối u ở bệnh nhân HCC có mức độ thấp (AFP <20 ng/ mL) (Choi JY et al, 2013 [3]).
|
Đặc điểm khối u |
Số bệnh nhân (n) |
AFP-L3 (>5%) |
DCP (>40 AU/L) |
AFP-L3 và DCP (>5%, >40 AU/L) |
|
Giai đoạn khối u I II III IV |
11 16 9 2 |
7 (63,6%) 12 (75,0%) 6 (66,7%) 2 (100%) |
5 (45,5%) 9 (56,3%) 6 (66,7%) 2 (100%) |
9 (81,8%) 16 (100%) 8 (88,9%) 2 (100%) |
|
Kích thước khối u <2 cm 2-5 cm >5cm |
15 17 6 |
7 (46,7%) 8 (47,1%) 3 (50,0%) |
6 (40,0%) 11 (64,7%) 5 (83,3%) |
13 (86,7%) 16 (94,1%) 6 (100%) |
|
Số lượng khối u 1 khối u Nhiều khối u |
24 14 |
16 (66,7%) 11 (78,6%) |
12 (50%) 10 (71,4%) |
22 (91,7%) 13 (92,7%) |
Như vậy, sự xác định kết hợp AFP-L3 và DCP có giá trị trong việc phát hiện sớm HCC ở các bệnh nhân có mức độ AFP tăng, tăng ít hoặc không tăng.
Khi sử dụng GALAD, một thông số được tính toán dựa trên 5 thông số, gồm ba dấu ấn khối u AFP, AFP-L3 và DCP cộng thêm với giới tính (Gender) và tuổi (Age), các nghiên cứu ở Anh Quốc, Nhật, Đức đều cho thấy giá trị đường cong ROC của GALAD cao hơn một cách có ý nghĩa so với của các dấu ấn AFP, AFP-L3 và DCP một mình trong HCC (Bảng 2).
Bảng 2. Độ nhạy, độ đặc hiệu và diện tích dưới đường cong (AUROC) của mô hình GALAD và các dấu ấn khối u khác của HCC (Berhane S, 2016 [2]).
|
Model/ Dấu ấn khối u |
Giá trị cắt (Cut-off value) |
Chẩn đoán sớm HCC (Tiêu chuẩn Milan) |
||||
|
AUC (95% CI) |
P (GALAD so với các dấu ấn HCC khác) |
Độ nhạy % |
Độ đặc hiệu % |
Phân loại chính xác % |
||
|
Anh Quốc GALAD AFP AFP-L3 DCP AFP+AFP-L3+DCP |
-0,63 20 ng/mL 7% 0,48 ng/mL Các giá trị tương ứng |
0,93 (0,90-0,96) 0,84 (0,79-0,89) 0,81 (0,76-0,85) 0,81 (0,77-0,86) 0,75 (0,72-0,77) |
- < 0,0001 < 0,0001 < 0,0001 < 0,0001 |
80,2 49,1 71,7 86,8 99,1 |
89,7 96,4 73,5 63,7 50,0 |
87,9 86,9 73,2 68,2 59,6 |
|
Nhật Bản GALAD AFP AFP-L3 DCP AFP+AFP-L3+DCP |
-1,95 20 ng/mL 7% 0,48 ng/mL Các giá trị tương ứng |
0,91 (0,90-0,92) 0,87 (0,86-0,89) 0,71 (0,70-0,73) 0,78 (0,76-0,80) 0,80 (0,78-0,81) |
- < 0,0001 < 0,0001 < 0,0001 < 0,0001 |
82,1 42,2 30,3 41,4 71,2 |
81,6 97,3 91,8 97,4 88,3 |
81,7 84,6 77,5 84,5 84,3 |
2. Các dấu ấn sinh học mới của HCC
Một số các dấu ấn sinh học mới có độ nhạy và độ đặc hiệu cao để phát hiện HCC đã được phát hiện, gồm: glypican 3 (GPC3), glutamine synthase (GS), heat shock protein 70 (HSP70) (mô), cytokeratin 19 (CK19), Golgi protein 73 (GP73), midkine, osteopontin (OPN), squamous cell carcinoma antigen (SCCA), Annexin A2, fibroblast growth factor 3/4 (FGF3/4), micro-RNAs (miRNAs), long non-coding RNAs (lncRNAs), circulating tumor cells (CTCs) và cell-free DNA (cfDNA). Ngoài ra, một số dấu ấn sinh học khác thu được bằng cách tiếp cận dựa trên bộ protein (proteomic) cũng đang được đánh giá (Zacharakis G, 2018 [12]).
2.1. Glypican 3 (GPC3)
GPC3 là một proteoglycan bề mặt tế bào thuộc họ glypican, được sản xuất quá mức ở các tế bào HCC và đóng một vai trò quan trọng trong việc điều chỉnh sự phát triển của khối u. Vì vậy, GPC3 có thể được sử dụng như một dấu ấn sinh học do có thể được sử dụng để phân biệt giữa bệnh nhân có khối u HCC nhỏ, biệt hóa tốt với bệnh nhân xơ gan. Các dấu ấn khác được sử dụng kết hợp với GPC3 gồm heat shock protein 70 (HSP70) và glutamine synthase (GS). HSP70 thuộc về một nhóm gen biểu hiện nhiều trong HCC tiến triển so với HCC sớm, và trong HCC sớm so với tổn thương tiền ung thư. Ngoài ra, sự tăng theo mức độ của GS từ tổn thương tiền ung thư đến HCC sớm và tiến triển cho thấy GS có vai trò trong HCC. GPC3 có thể được sử dụng một mình hoặc kết hợp với HSP70 và GS để phân biệt HCC với xơ gan.
2.2. Cytokeratin 19 (CK19)
CK19 là một dấu ấn sinh học HCC mới có liên quan đến tiên lượng xấu ở bệnh nhân HCC do nguy cơ cao xâm lấn vi mạch và di căn xa, cũng như hiệu quả điều trị kém hơn.
2.3. Protein phức hợp Golgi 73 (Golgi protein 73: GP73)
GP73 là một protein xuyên màng có trong phức hợp Golgi. Mặc dù nó không có trong tế bào gan bình thường, nhưng có sự biểu hiện quá mức ở bệnh nhân HCC, so với bệnh nhân xơ gan. GP73 có thể được sử dụng như một dấu ấn sinh học để phát hiện sớm HCC.
2.4. Osteopontin (OPN)
OPN là một glycoprotein, một protein nền ngoại bào, được biểu hiện trong các tế bào HCC và các loại khối u ác tính khác nhau. OPN có độ nhạy cao hơn AFP trong phát hiện sớm HCC. Độ đặc hiệu thấp của nó có thể được giải thích bởi sự liên quan của nó với hơn 30 loại ung thư khác nhau. Do đó, cần kết hợp OPN với AFP để tối ưu hóa hiệu suất chẩn đoán HCC.
2.5. Kháng nguyên ung thư tế bào vảy (Squamous Cell Carcinoma Antigen: SCCA)
SCCA là một chất ức chế serine protease, được thấy trong biểu mô vảy. Việc sử dụng SCCA như một dấu hiệu chẩn đoán bổ sung với AFP cho HCC đã được ghi nhận. Ngoài ra, nó có thể đóng một vai trò như một dấu ấn sinh học cho đáp ứng với điều trị vì nó có sự tương quan nghịch với đáp ứng điều trị HCC. Sự kết hợp của AFP và SCCA nên được nghiên cứu thêm để xác nhận vai trò của nó trong dự báo nguy cơ HCC ở bệnh nhân bị bệnh gan mạn.
2.6. Annexin A2
Annexin A2 là một protein liên kết với phospholipid, phụ thuộc canxi, có mặt ở bề mặt tế bào và có liên quan đến sự phát triển và di căn của HCC. Annexin A2 được sử dụng như một dấu ấn sinh học huyết tương để chẩn đoán và tiên lượng bệnh nhân HCC giai đoạn sớm với độ nhạy và độ đặc hiệu cao hơn AFP.
2.7. Các microRNA (miRNAs)
Các microRNA (miRNA) là các RNA nội sinh, nhỏ (17-25 nucleotide), không mã hóa, có liên quan đến các vai trò sinh học khác nhau ở cấp độ tế bào bao gồm quá trình chết tế bào được lập trình (apoptosis) và ung thư. Các cơ chế điều hòa chính của miRNA bao gồm tăng sinh (proliferation), chết tế bào được lập trình (apoptosis), xâm lấn (invasion), di căn (metastasis), chuyển tiếp biểu mô-trung mô (epithelial-mesenchymal transition: EMT), hình thành mạch (angiogenesis) và kháng thuốc (drug resistance) trong HCC. Các miRNA cũng đóng vai trò quan trọng trong sự tăng sinh, xâm lấn, di căn và kháng thuốc trong HCC bằng cách điều chỉnh biểu hiện gen ở tế bào đích. Các phương pháp phổ biến được sử dụng để phát hiện các miRNA là microarray, PCR và giải trình tự gen (Bảng 3)
Bảng 3. Các miRNA biểu hiện bất thường và các gen đích của chúng (Singh AK, 2018 [5]).
|
TT |
Các miRNA |
Các gen đích |
Chức năng của miRNA |
Sự biểu hiện của miRNA |
|
1 |
miR-21 |
PTEN, RECK, PDCD4 |
Hoạt tính chống sự chết tế bào được lập trình, thúc đẩy di căn và xâm lấn |
↑↑ |
|
2 |
miR-106b |
E2F1, RhoGTPase, RhoA, RhoC |
Thúc đẩy sự di trú của tế bào và sự hình thành sợi actin |
↑↑ |
|
3 |
miR-17-5p |
P38, con đường MARK, E2F1, c-MYC |
Thúc đẩy tính ác tính và sự di căn |
↑↑ |
|
4 |
miR-151 |
RhoDIA, FAK |
Thúc đẩy sự di căn và xâm lấn |
↑↑ |
|
5 |
miR-122 |
CyclinG1, ADAM10, SRF, IGF1R, PTTG1, PBF, CULT1, |
Đáp ứng đối với sự ức chế sao chép của virus và sự sinh sôi của tế bào |
↓↓ |
|
6 |
miR-143 |
FNDC3B |
Thúc đẩy sự di căn của khối u |
↑↑ |
|
7 |
miR-210 |
VMP |
Thúc đẩy tình trạng thiếu oxy biểu mô được cảm ứng đến quá trình chuyển vị trung mô |
↑↑ |
|
8 |
miR-29 |
MEG3, Bel-2, Met-1 |
Thúc đẩy sự chết tế bào được lập trình và ức chế sự phát triển của khối u |
↓↓ |
|
9 |
Iet-7 |
eMyc, p16, Bel-x1, COLIA2 |
Ức chế sự phát triển và sự sinh sôi của tế bào |
↓↓ |
|
10 |
miR-26a |
Cyclin D2, Cyclin E2, Cyclin E1, CDK6, IL-6 |
Ức chế sự di căn, sự xâm lấn và phát triển của khối u |
↓↓ |
|
11 |
miR-221 |
CDKN1B/p27, CDKN1C/p57, DDIT4, PTEN, BmF, TIMP3, PPP2R2A |
Chống sự chết tế bào được lập trình, giúp sự di căn và phát triển của khối u |
↑↑ |
|
12 |
miR-1 |
FoxP1, MET, HDAC4 |
Ức chế sự phát triển tế bào và làm giảm khả năng sao chép |
↓↓ |
|
13 |
miR-195 |
Cyclin D1, CDK6, E2F3, LATS2, VEGF, VAV2, CDC42, IKKα và TAB3, con đường TNF-α/NF-κB |
Ức chế sự di căn, sự chuyển vị G1/S, sự tạo mạch máu và giúp sự chết tế bào được lập trình |
↓↓ |
|
14 |
miR-45 |
OCT4, IRS1, tìn hiệu IGF, HDAC2 |
Ức chế sự sinh sôi, sự di cư tế bào và sự xâm lấn |
↓↓ |
|
15 |
miR-224 |
API-5, CDC42, CDH1, PAK2, BCL-2, MARK1, PPP2R1B |
Thúc đẩy sự sinh sôi, di cư tế bào, sự xâm lấn, ức chế sự chết tế bào được lập trình |
↑↑ |
Như vậy, miRNA là dấu ấn sinh học đầy hứa hẹn trong lĩnh vực chẩn đoán, tiên lượng HCC và các điều trị đích tiềm năng.
2.8. Các RNA không mã hóa chuỗi dài (long non-coding RNAs: lncRNAs)
Các RNA không mã hóa chuỗi dài (lncRNA) là một lớp duy nhất các bản sao của hơn 200 nucleotide có trong phân tích toàn bộ hệ gen của phiên mã động vật có vú. Các bằng chứng cho thấy lncRNA bị rối loạn điều hòa có liên quan đến cơ chế bệnh sinh của HCC. Gần đây, IncRNA đã được công nhận là chất điều hòa quan trọng đối với sự chuyển hóa carbohydrate và lipid, điều này đã dẫn đến việc khám phá ra một dấu ấn sinh học mới được đặt tên là “IncRNA Ftx” có tác dụng kích thích sự tiến triển của HCC và sự đường phân. Do đó, IncRNA Ftx có thể hoạt động như một dấu ấn thử nghiệm để nghiên cứu thêm trong liệu pháp cho HCC. Một nghiên cứu tiến cứu gần đây đề nghị kết hợp đo lncRNA và AFP có thể là một dấu hiệu hữu ích mới có liên quan đến chẩn đoán và tiên lượng HCC. Sự biểu hiện của RP11-466I1 trong huyết tương và mô HCC có liên quan đến sự xâm lấn nang của khối u (Wang W, 2020 [11]).
2.9. Các tế bào khối u trong máu tuần hoàn (circulating tumor cells: CTCs)
Một trong những đặc điểm tiên lượng bất lợi nhất của HCC là sự hiện diện của sự xâm lấn mạch máu dẫn đến lan rộng về huyết học và di căn xa của các tế bào ác tính. Việc phát hiện các tế bào khối u trong máu tuần hoàn (CTCs) có giá trị lâm sàng quan trọng trong dự đoán HCC tái phát và theo dõi đáp ứng điều trị. Việc phát hiện các tế bào khối u trong máu tuần hoàn có liên quan đến thời gian sống sống sót giảm và tỷ lệ tái phát tăng. Ngoài ra, sự có mặt của các tế bào khối u trong máu có sự tương quan có ý nghĩa với mức độ AFP huyết tương, độ xâm lấn mạch máu và giai đoạn của khối u, hạch và di căn (TNM), và có thể phản ánh tình trạng mô bệnh học của HCC.
2.10. DNA tách khỏi tế bào (cell-free DNA: cfDNA)
Mức độ DNA tách khỏi tế bào (cfDNA) không được điều chỉnh có vai trò trong chẩn đoán, theo dõi đáp ứng điều trị và thậm chí dự đoán kết quả đối với các bệnh ung thư. Hơn nữa, sự đa hình đơn nucleotide của cfDNA như đột biến Ser249 p53 thường được tìm thấy trong DNA huyết tương, thật không may, lại được phát hiện ở các cá thể HCC và không phải HHC. Tuy nhiên, các dấu hiệu methyl hóa khác biệt được xác định trong cfDNA, trước khi xuất hiện HCC, được khuyến cáo sử dụng kết hợp với AFP để cải thiện độ chính xác của chẩn đoán HCC. Việc theo dõi cfDNA trong nước tiểu cũng là một công cụ đầy hứa hẹn để dự đoán sự tái phát của HCC (Wang W, 2020 [11]).
2.11. Bộ các chất chuyển hóa trong huyết tương (Metabolomics)
Bộ các chất chuyển hóa (metabolomics) trong huyết tương cho phép xác định đặc tính của chất chuyển hóa có nguồn gốc từ khối u trong dịch cơ thể. Trong HCC, các chất chuyển hóa không ổn định từ các loại hợp chất khác nhau đã được xác định, bao gồm axit amin, axit mật, lysophosphatidylcholine (LPC), axit béo tự do (FFA), phenylalanyl-tryptophan và glycocholate. Một nghiên cứu gần đây cho thấy có 104 chất chuyển hóa được phát hiện là bị rối loạn điều hòa trong huyết tương của bệnh nhân HCC so với đối chứng khỏe mạnh. Tổng cộng, 13 chất chuyển hóa có AUC cao nhất (0,785-0,895), độ nhạy (65-90%) và độ đặc hiệu (60-100%) chẩn đoán HCC tốt hơn hoặc tương đương với AFP (AUC: 0,808, độ nhạy: 80%, độ đặc hiệu: 70% ). Ngoài huyết tương, nước tiểu là một nguồn lý tưởng của các chất chuyển hóa. Các chất chuyển hóa trong nước tiểu được biểu hiện khác nhau ở các bệnh nhân bị HCC. Bản đồ các chất chuyển hóa trong nước tiểu ở bệnh nhân HCC khác biệt với ở các bệnh nhân xơ gan, bệnh gan và nhóm chứng khỏe mạnh, gồm inosine, indole-3-acetate, galactose, axit amin N-acetyl hóa (NAA), được đề xuất như một dấu hiệu nước tiểu đầy hứa hẹn với độ nhạy 86,9% và độ đặc hiệu 90,3% để chẩn đoán phân biệt HCC với xơ gan.
2.12. Các protein lõi bị fucosyl hóa (Core-fucosylated proteins: CFs)
Các protein lõi bị fucosyl hóa (CFs) có thể là dấu ấn sinh học ứng viên trong chẩn đoán HCC. CF từ fibronectin tại vị trí 1007 có thể giúp phân biệt HCC với xơ gan ở những bệnh nhân mắc bệnh gan do rượu. Ngoài ra, CF cadherin-5 tại vị trí 61 có thể phân biệt giữa HCC ở bệnh gan viêm gan HCV mạn với xơ gan. Hơn nữa, bốn đồng dạng (isoforms) của apolipoprotein được biểu hiện khác nhau có thể giúp phân biệt bệnh gan không do rượu (NAFLD) không xơ gan với NAFLD xơ gan hoặc HCC trên nền NAFLD xơ gan. Sự phân tích bộ các protein huyết tương (proteomics) được chứng minh là chính xác hơn một số dấu ấn sinh học thông thường cho HCC giai đoạn sớm.
3. Giá trị của các dấu ấn sinh học mới trong chẩn đoán sớm, tiên lượng và đánh giá đáp ứng điều trị HCC
Cho đến nay, mặc dù chưa có dấu ấn sinh học mới nào được chứng minh là có ưu điểm vượt trội rõ ràng hơn so với các dấu ấn sinh học cũ trong chẩn đoán sớm, tiên lượng và đánh giá đáp ứng điều trị HCC, nhưng các dấu ấn sinh học mới đang mở ra một tương lai đầy hứa hẹn.
3.1. Giá trị của các dấu ấn sinh học mới trong đánh giá nguy cơ HCC
Các bệnh nhân xơ gan cần được khám sàng lọc định kỳ phù hợp để phát hiện sớm sự phát triển của HCC. Việc xác định các yếu tố vật chủ như các dấu ấn sinh học của các con đường sinh học khác nhau liên quan đến quá trình sinh ung thư gan có thể giúp xác định các quy trình sàng lọc thích hợp cụ thể. Nhiều nghiên cứu về gen ứng viên cho thấy có sự liên quan giữa những đa hình nucleotide đơn (single nucleotide polymorphisms: SNPs) với nguy cơ HCC. Tuy nhiên, một số SNP vật chủ được xác định chỉ giải thích được một phần sự liên quan với HCC ở bệnh nhân nhiễm HCV. Cho đến nay, hai dấu ấn sinh học có thể giúp dự đoán nguy cơ HCC là đa hình nucleotide đơn (SNP) ở yếu tố tăng trưởng biểu bì dòng mầm (germ-line epidermal growth factor receptor: EGFR) và ở gen 186 đặc hiệu ở bệnh nhân xơ gan (Zacharakis G, 2018 [12]).
3.2. Giá trị của các dấu ấn sinh học mới trong chẩn đoán sớm HCC
Chẩn đoán HCC không xâm lấn sử dụng các tiêu chuẩn của EASL/ AASLD cho phép chẩn đoán hầu hết các khối HCC đường kính trên 2 cm. Tuy nhiên, do hình ảnh ít đáng tin cậy hơn ở một phần ba số nốt nhỏ, việc sinh thiết gan cần được chỉ định. Trong trường hợp này, EASL khuyến nghị nên xét nghiệm kết hợp cả 3 dấu ấn hóa mô miễn dịch (GPC3, HSP70 và GS). Ngoài ra, dấu ấn 3 gen gồm GPC3, thụ thể hyaluronan nội mô mạch bạch huyết 1 và Survivin cũng được đề xuất sử dụng như một công cụ phân tử chính xác (độ nhạy 95% và độ đặc hiệu là 94%) để phân biệt các nốt loạn sản và các khối u HCC nhỏ hơn 2 cm ở bệnh nhân HCV mạn. Một bước tiến trong chẩn đoán HCC đã được tạo ra nhờ “sinh thiết lỏng” (liquid biopsy) để xác định các tế bào khối u trong máu tuần hoàn (CTCs) và DNA đã tách khỏi khối u (cfDNA).
3.3. Giá trị của các dấu ấn sinh học mới trong tiên lượng HCC
Về các dấu hiệu tiên lượng cho HCC, sự đa dạng về kiểu hình và phân tử của HCC cho phép các nhà khoa học xác định một số dấu ấn sinh học mới. Số điểm của 5 gen (5-gene score) dựa trên sự biểu hiện của 5 gen TAF9, RAN, RAMP3, KRT19 và HN1, đại diện cho yếu tố dự đoán đáng tin cậy nhất về khả năng sống sót được xác định cho đến nay ở nhiều nghiên cứu. Ngoài ra, các gen liên quan đến sự tân tạo mạch (một bảng gồm các microRNA liên quan đến điều hòa sự hình thành mạch máu) có thể là dấu hiệu của các HCC phát triển nhanh và khả năng sống sót kém. Ngoài ra, số điểm của gen 186 từ các mô lân cận của khối u cũng được chứng minh là có ý nghĩa tiên lượng độc lập để dự đoán khả năng sống sót của bệnh nhân HCC.
3.4. Giá trị của các dấu ấn sinh học trong đánh giá hiệu quả điều trị đích HCC
Khả năng sử dụng các dấu ấn sinh học mới để dự đoán tác dụng của điều trị đích đối với HCC hiện đang được nghiên cứu. Yếu tố tăng trưởng nguyên bào sợi (Fibroblast Growth Factor: FGF) là một thành phần cơ bản của quá trình sinh ung thư. Sự khuếch đại FGF3/ FGF4 có giá trị dự đoán khả năng tăng đáp ứng với sorafenib ở bệnh nhân HCC. Sorafenib, một chất ức chế tyrosine kinase, là một thuốc điều trị đích, được sử dụng ở bệnh nhân HCC giai đoạn cuối. Các dấu hiệu dự đoán khác về hiệu quả của sorafenib bao gồm mức độ cao của thụ thể của yếu tố tế bào gốc hòa tan (stem cell factor: SCF hoặc c-Kit) và mức độ thấp của yếu tố tăng trưởng tế bào gan (hepatocyte growth factor) cho thấy xu hướng không có ý nghĩa đối với hiệu quả của sorafenib. Hơn nữa, ở bệnh nhân HCC liên quan đến HCV sorafenib thể hiện tác dụng tốt hơn (HR: 0,47) so với ở bệnh nhân HCC không bị HCV (HR: 0,81).
Các thuốc điều trị đích khác đối với HCC gồm lenvaitinb và regorafenib là thuốc điều trị đích dạng phân tử nhỏ điều trị hàng đầu và cabozantinib và ramucirumab là thuốc điều trị đích dạng kháng thể đơn dòng hàng đầu. Trong thử nghiệm REACH-2 giai đoạn III, người ta đã chứng minh rằng ramucirumab là thuốc điều trị đích bậc hai đã đạt được lợi ích sống còn rõ rệt và an toàn ở bệnh nhân HCC có nồng độ AFP huyết tương ≥400 ng/ mL, một tình trạng có tiên lượng xấu; ramucirumab có tác dụng làm giảm tỷ lệ tử vong 29% so với giả dược là thuốc điều trị đích hàng đầu cho những bệnh nhân HCC tiến triển cấp và AFP là một yếu tố dự báo hiệu quả của ramucirumab. Một loại thuốc điều trị đích HCC khác là nivolumab, trong một thử nghiệm lâm sàng giai đoạn I-II gần đây trên 260 bệnh nhân HCC tiến triển cho thấy có đến 16% đáp ứng thuận lợi, thời gian sống thêm trung bình là 16 tháng (Zacharakis G, 2018 [12]).
3.5. Giá trị của các dấu ấn sinh học mới trong lựa chọn thuốc điều trị đích
GPC3 là một proteoglycan heparan sulfat liên kết màng có thể được sử dụng làm dấu ấn sinh học cho HCC. Các nghiên cứu gần đây đã chỉ ra rằng nó có vai trò trong quá trình sinh bệnh và tăng sinh ung thư và do đó có thể được sử dụng như một đích điều trị để ngăn chặn sự tiến triển và tăng sinh của các tế bào khối u. Một dấu ấn sinh học khác và là đích điều trị là kinesin C1 (KIFC1). KIFC1 được biểu hiện quá mức ở mô khối u HCC so với các mô không phải khối u, do đó, nó có thể được sử dụng như một dấu ấn sinh học và là một đích cho điều trị HCC.
Giá trị của chẩn đoán hình ảnh và của các dấu ấn sinh học huyết tương cũ và mới trong chẩn đoán sớm HCC có thể được tóm tắt ở bảng 4.
Bảng 4. Giá trị của chẩn đoán hình ảnh và của các dấu ấn sinh học huyết tương cũ và mới trong chẩn đoán sớm HCC (Tsuchiya N, 2015 [9], Berhane S, 2016 [2], Ayoub WS, 2019 [1])
|
Chẩn đoán hình ảnh và dấu ấn sinh học |
Độ nhạy, % (95% CI) |
Độ đặc hiệu, % (95% CI) |
|
Siêu âm |
51-87 |
80-100 |
|
Chụp cắt lớp (CT) |
68-91 |
87-98 |
|
Cộng hưởng từ (MRI) |
77-100 |
84-97 |
|
Siêu âm tăng độ tương phản |
85 |
91 |
|
AFP |
53 (46-59) |
90 (87-93) |
|
AFP-L3 |
28 (22-34) |
97 (93-100) |
|
DCP |
61 (55-68) |
70 (65-74) |
|
AFP+AFP-L3+DCP |
71,2 |
88,3 |
|
GALAD |
82,1 |
81,6 |
|
GPC3 |
55,1 (47,9-66,2) |
97,0 (95,2-98,2) |
|
OPN |
75 (58-93) |
62 (51-73) |
|
GP73 |
62 |
88 |
|
Bộ miRNA |
82,5 |
83,5 |
Ghi chú: bộ miRNA gồm miR-122, miR-192, miR-21, miR-223, miR-26a, miR-27a and miR-801.
Tóm lại, cho đến nay, chưa có một dấu ấn sinh học đơn lẻ nào hoặc một sự kết hợp các dấu ấn sinh học nào đủ tin cậy để chẩn đoán HCC xác định mà không có các đặc điểm mô học hoặc X quang để khẳng định. Độ chính xác chẩn đoán, đặc biệt đối với HCC giai đoạn sớm, có thể được cải thiện bằng cách kết hợp hai hoặc nhiều dấu ấn sinh học để đạt độ nhạy chấp nhận được (>80%) với độ đặc hiệu vừa phải. Độ chính xác chẩn đoán HCC cũng có thể được cải thiện bằng cách đo sự biến thiên theo thời gian của các dấu ấn sinh học và sự kết hợp các dấu ấn sinh học. Cho đến nay, nồng độ AFP huyết tương vẫn còn được sử dụng phổ biến để đánh giá đáp ứng điều trị ở bệnh nhân HCC có AFP tăng và tiên lượng HCC, nồng độ AFP tăng là một yếu tố tiên lượng kém đối với bệnh nhân. Các nghiên cứu hiện nay đang hướng đến sự phát triển các dấu ấn sinh học mới nhằm giúp chẩn đoán sớm HCC, theo dõi hiệu quả điều trị, phát hiện tái phát và hướng dẫn điều trị đích.
Tài liệu tham khảo
- Ayoub WS, Steggerda J, Yang JD, et al. Current status of hepatocellular carcinoma detection: screening strategies and novel biomarkers. Ther Adv Med Oncol 2019; 11: in press.
- Berhane S, Toyoda H, Tada T, et al. Role of the GALAD and BALAD-2 Serologic Models in Diagnosid of Hepatocellular Carcinoma and Prediction of Survival in Patients. Clin Gastroenterol Hepatol 2016; 14(6): 875-886.
- Choi JY, Jung SW, Kim HY, Kim M, Kim Y, Kim DG and Oh E. Diagnostic value of AFP-L3 and PIVKA-II in hepatocellular carcinoma according to total-AFP. World J Gastroenterol 2013 Jan 21; 19(3): 339-346.
- Marrero JA, Romano PR, Nikolaeva O, et al. GP73, a resident Golgi glycoprotein, is a novel serum marker for hepatocellular carcinoma. J Hepatol 2005; 43: 1007-1012.
- Singh AK, Ramesh Kumar R, and Pandey AK. Hepatocellular Carcinoma: Causes, Mechanism of Progression and Biomarkers. Curr Chem Genom Transl Med 2018; 12: 9-26.
- Sterling RK, Jeffers L, Gordon F, et al. Utility of Lens culinaris Agglutinin-Reactive Fraction of α-Fetoprotein and Des-Gamma-Carboxy Prothrombin, Alone or in Combination, as Biomarkers for Hepatocellular Carcinoma. Clin Gastroenterol Hepatol 2009; 7: 104-113.
- Tateishi R, Yoshida H, Matsuyama Y, et al. Diagnostic accuracy of tumor markers for hepatocellular carcinoma: A systematic review. Hepatol Int 2007; 2: 17-30.
- Trevisani F, Dintino PE, Morselli-Labate AM, et al. Serum a-fetoprotein for diagnosis of hepatocellular carcinoma in patients with chronic liver disease: Influence of HBsAg and anti-HCV statsiêu âm. J Hepatol 2001; 2001: 570-575.
- Tsuchiya N, Sawada Y, Endo I. Biomarkers for the early diagnosis of hepatocellular carcinoma. World J Gastroenterol 2015 Oct 7; 21(37): 10573-10583.
- Wang W and Wei C. Advances in the early diagnosis of hepatocellular carcinoma. Article Genes & Diseases 2020; 7(3): 308-319.
- Yang JD, Hainaut P, Gores GJ, et al. A global view of hepatocellular carcinoma: trends, risk, prevention and management. Nature Reviews Gastroenterology & Hepatology 2019; 16: 589-604.
- Zacharakis G, Aleid A, Aldossari KK. New and old biomarkers of hepatocellular carcinoma. Hepatoma Res 2018; 4: 65.
Bình luận ()
Lựa chọn dịch vụ
Quý khách hàng vui lòng lựa chọn dịch vụ y tế theo nhu cầu!