Tin tức
Ung thư dạ dày: cơ sở phân tử và điều trị đích
Theo Tổ chức Y tế thế giới, trong năm 2012, số ca ung thư dạ dày được phát hiện trên thế giới là 950.000 người, chiếm 7% tổng số các loại ung thư và là nguyên nhân tử vong thứ ba do ung thư trên toàn thế giới, với 723.000 ca tử vong (theo ACS 2011). Tỷ lệ mắc ung thư dạ dày khác nhau giữa các vùng địa lý trên thế giới, Nhật Bản và Hàn Quốc có tỷ lệ mắc cao nhất. Ở Mỹ, năm 2014 ước tính có 22.220 trường hợp mắc ung thư dạ dày mới và 10.990 ca tử vong (theo ACS 2014).
Ung thư dạ dày có thể được coi như là một bệnh đa yếu tố bởi vì nhiều yếu tố di truyền và môi trường đóng một vai trò trong sinh ung thư, bao gồm cả cơ sở di truyền của vật chủ, các tác nhân nhiễm khuẩn như Helicobacter pylori và thói quen ăn uống. Hai vị trí chủ yếu hay gặp của ung thư dạ dày là vùng tâm vị (vùng gần tâm vị, vùng nối dạ dày thực quản) và vùng không tâm vị (các vùng đáy, thân, xa tâm vị và vùng thấp hơn hoặc cao hơn bờ cong nhỏ). Tỷ lệ mắc các khối u không tâm vị hiện đang giảm, có thể do tỷ lệ thấp hơn của nhiễm H. Pylori do chế độ ăn uống, điều kiện lưu trữ thực phẩm và vệ sinh chung được cải thiện (Parsonnet et al. 1991 [8]). Sự nhiễm H. Pylori là một yếu tố gây bệnh quan trọng của ung thư dạ dày thể đường ruột (Parsonnet và cộng sự, 1991 [8]).
Các khối u dạ dày có thể không hoạt động, có thể tiến triển tại chỗ hoặc di căn. Việc chẩn đoán ung thư dạ dày thường chậm trễ vì nhiều bệnh nhân bị bệnh ở giai đoạn đầu triệu chứng không rõ ràng, không đặc hiệu hoặc không có triệu chứng. Khi được phát hiện ở giai đoạn muộn, bệnh thường kháng với hóa trị liệu và thời gian sống sót giảm (Bảng và cộng sự 2010 [2]). Ngay cả số bệnh nhân bị bệnh có thể phẫu thuật cũng chỉ có khoảng 1/3 có cơ hội sống sót sau 5 năm.
1. Sự khuếch đại gen HER2 và sự thể hiện quá mức của protein thụ thể HER2
Về cơ sở phân tử của ung thư dạ dày, có khoảng 7-34% số các ung thư dạ dày thể hiên sự khuếch đại gen gây ung thư của thụ thể HER2 (HER2 amplification) (Bảng và cộng sự 2010 [2]).
Về tầm quan trọng của thụ thể HER2 (HER2 receptor) trong ung thư dạ dày, các nhà khoa học thấy rằng: gia đình thụ thể của yếu tố tăng trưởng biểu mô người EGFR (human epidermal growth factor receptor) gồm 4 thụ thể (ErbB1-4) có thể được hoạt hóa bởi ligand được tạo thành bởi sự polymer hóa của hai chuỗi polymer giống hoặc khác nhau. Trong ung thư vú, người ta biết rằng thụ thể HER2 đóng một vai trò quan trọng bởi vì thụ thể này hoạt động trong quá trình tạo thành đặc biệt của ung thư này. Trong sự thể hiện quá mức (over-expression) của protein thụ thể ErbB2 thường hay gắn vào các thành phần gia đình khác và kích hoạt các con đường tín hiệu ảnh hưởng đến sự tăng trưởng tế bào, sự chết tế bào theo chương trình (apoptosis), sự di căn (metastasis) và sự tạo thành mạch máu (angiogenesis) trong ung thư vú. Mặc dù cho đến nay người ta còn biết ít về các con đường phân tử bị cảm ứng bởi thụ thể HER2 trong ung thư dạ dày so với ung thư vú, nhưng các công trình khoa học được công bố gần đây gợi ý rằng thụ thể HER2 cũng đóng một vai trò tương tự như trong ung thư dạ dày.
Có bằng chứng cho rằng HER2 còn là một yếu tố tiên lượng cho ung thư dạ dày. Tương tự như ung thư vú, sự thể hiện quá mức của protein thụ thể HER2 có liên quan đến thời gian sống sót của bệnh nhân ngắn hơn. Tỷ lệ khuếch đại của gen HER2 và sự thể hiện quá mức của protein thụ thể HER2 là 22,1%, tỷ lệ này cũng tương tự như ở ung thư vú. Tuy nhiên, có một sự khác nhau về tỷ lệ HER2 (+) tính khi sử dụng các kỹ thuật xác định khác nhau: với kỹ thuật xác định hóa mô miến dịch IHC (immunohistochemistry assay), tỷ lệ này là 6,8 đến 34,0%, còn với kỹ thuật lai huỳnh quang tại chỗ FISH (fluorescence in situ hybridization), tỷ lệ này là 7,1-42,6%.
Cũng cần chú ý thêm là: trong ung thư dạ dày, các tế bào thể hiện của thụ thể HER2 được phân bố ở cặp chuỗi polypeptide khác nhau nhiều hơn so với ở cặp chuỗi giống nhau, điều này giải thích sự khác nhau về vai trò tạo thành ung thư của HER2 giữa hai bệnh này. Sự khuếch đại gen và sự thể hiện quá mức của protein của thụ thể HER2 thường chiếm ưu thể trong ung thư dạ dày thể ruột (intestinal type gastric cancer) so với ung thư dạ dày thể lan tỏa (diffuse gastric cancer). Hơn nữa, tỷ lệ khuếch đại gen và sự thể hiện quá mức của protein của thụ thể HER2 cũng phụ thuộc vị trí của khối u: sự thể hiện của HER2 trong ung thư ở vùng nối dạ dày thực quản (gastroesophageal junction) cao hơn ung thư ở vùng dạ dày và cũng có thể cao hơn ung thư ở vùng thực quản.
Ngoài ra, việc xác định các đột biến của E-cadherin dòng mầm (germline E-cadherin (CDH1) mutations) ở các gia đình có ung thư dạ dày lan tỏa di truyền đã thể hiện một quan điểm mới về những thay đổi ban đầu có khả năng kích hoạt yếu tố sinh ung thư dạ dày (tumorigenesis) và khẳng định CDH1 như là một yếu tố áp chế khối u (tumor suppressor factor) (Nadauld và cộng sự 2013 [7]. Vai trò của sự thay đổi CDH1 trong điều trị đích ung thư dạ dày hiện đang được tiếp tục nghiên cứu (Corso G và cộng sự 2013 [3]).
Vai trò của những thay đổi cách biểu hiện (epigenetic changes) và sự im lặng của các yếu tố áp chế ung thư (tumor-suppressor silencing) qua sự thúc đẩy sự methyl hóa quá mức (hypermethylation) trong các ung thư cũng gợi ý về việc sử dụng các thuốc chống lại sự methyl hóa như 5-azacytadine trong điều trị đích ung thư dạ dày (Zouridis và cộng sự 2012 [10]).
Cũng có bằng chứng gợi ý rằng các thay đổi thể sôm (somatic alterations) như sự khác nhau về số bản copy ở những gen gây ung thư then chốt như FGFR2, EGFR và MET có thể được nghiên cứu cho điều trị đích ung thư dạ dày (Nadauld và cộng sự 2012 [6], Deng và cộng sự 2012 [4], Wadhwa R và cộng sự 2013 [9]).
Những thay đổi về phân tử trong ung thư dạ dày ở các gen p53, PTEN và PIK3CA hiện cũng đang được nghiên cứu để phục vụ cho điều trị đích ung thư dạ dày (Lee J và cộng sự 2012 [5]).
2. Điều trị đích ung thư dạ dày
Dựa trên các phát hiện về sự khuếch đại gen gây ung thư HER2 và sự thể hiện quá mức của protein thụ thể HER2 như là bệnh sinh của ung thư dạ dày, một kháng thể đơn dòng nguồn gốc người trực tiếp chống lại thụ thể HER2 (humanized monoclonal antibody directed against the HER2 receptor) là trastuzumab - một thuốc điều trị đích ung thư dạ dày đầu tiên - được đánh giá trong nghiên cứu giai đoạn III là có hiệu quả điều trị đích cho ung thư dạ dày thể tuyến (gastric adenocarcinoma) và ung thư dạ dày thực quản thể tuyến (gastroesophageal junction GEJ) có HER2 (+) tính (Albarello và cộng sự 2011 [1]). Trong một thử nghiệm lâm sàng (Bảng và cộng sự 2010 [2]), việc kết hợp giữa trastuzumab và hóa trị liệu đã cải thiện đáng kể thời gian sống của bệnh nhân so với hóa trị liệu một mình (Bảng 1).
Bảng 1. Kết quả thử nghiệm lâm sàng kết hợp điều trị đích và hóa trị liệu giai đoạn III ở các bệnh nhân ung thư dạ dày có HER2 (+) tính (Bảng và cộng sự 2010[2])
|
Điều trị |
Sự khuếch đại gen HER2 |
Số bệnh nhân (n) |
Tỷ lệ đáp ứng |
Thời gian sống sót |
|
Trastuzumab + Hóa trị liệu |
Tất cả các trạng thái HER2 |
298 |
47% |
13,6 |
|
HER2 cao |
|
|
16,0 |
|
|
HER2 thấp |
|
|
10,0 |
|
|
Hóa trị liệu |
Tất cả các trạng thái HER2 |
296 |
35% |
11,1 |
|
HER2 cao |
|
|
11,8 |
|
|
HER2 thấp |
|
|
8,7 |
Ngoài ra, những thay đổi về phân tử khác như sự khuếch đại của các gen FGFR2, EGFR, MET, …, cũng đang được nghiên cứu cho điều trị đích ung thư dạ dày với các thuốc kháng thể đơn dòng (như ramucirumab cho điều trị đích VEGFR; cetuximab, matuzumab, panitumumab và nimotuzumab cho điều trị đích EGFR/HER1) vả các thuốc điều trị đích phân tử nhỏ (như crizotinib, … cho điều trị đích MET) (Wadhwa R và cộng sự, 2013 [9]) (Hình 1).
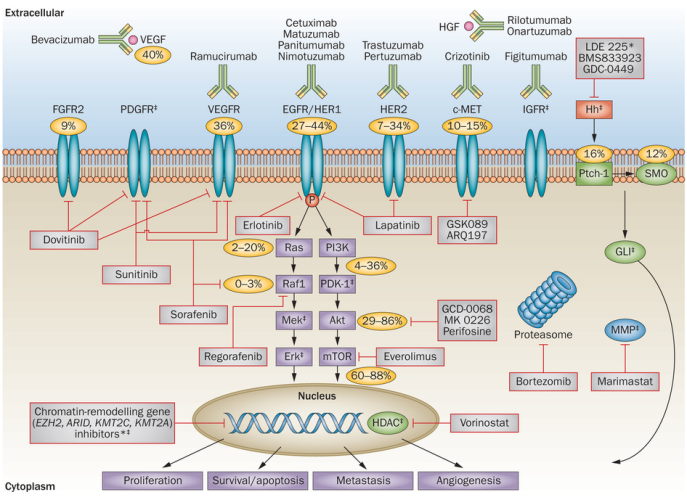
Hình 1. Sơ đồ các con đường tín hiệu và vị trí tác động của các thuốc trong điều trị đích trong ung thư dạ dày (Wadhwa R và cộng sự 2013 [9]).
KẾT LUẬN
1. Về cơ sở phân tử của ung thư dạ dày: sự khuếch đại gen gây ung thư của thụ thể HER2 và sự thể hiện quá mức của protein thụ thể HER2 đóng vai trò chủ yếu trong cơ chế sin hung thư của ung thư dạ dày.
2. Trong điều trị đích ung thư dạ dày, sự khuếch đại gen của thụ thể HER2 và sự thể hiện quá mức của protein thụ thể HER2 đã trở thành đích cho thuốc điều trị đích kháng thể đơn dòng trastuzumab.
3. Trên cơ sở những thay đổi phân tử khác trong ung thư dạ dày như các đột biến trên gen CDH1, sự methyl hóa quá mức, sự khuếch đại của các gen gây ung thư khác FGFR2, EGFR và MET hiện đang được nghiên cứu cho điều trị đích ung thư dạ dày.
TÀI LIỆU THAM KHẢO
1. Albarello L, Pecciarini L, and Doglioni C. HER2 testing in gastric cancer. Adv Anat Pathol 2011 Jan; 18(1): 53-59.
2. Bang Y, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010 Aug 28; 376(9742): 687-697.
3. Corso G, Carvalho J, Marrelli D, et al. Somatic mutations and deletions of the E-cadherin gene predict poor survival of patients with gastric cancer. J Clin Oncol 2013; 31: 868-875.
4. Deng N, Goh LK, Wang H, et al. A comprehensive survey of genomic alterations in gastric cancer reveals systematic patterns of molecular exclusivity and co-occurrence among distinct therapeutic targets. Gut 61: 673-684.
5. Lee J, van Hummelen P, Go C, et al. High-Throughput Mutation Profiling Identifies Frequent Somatic Mutations in Advanced Gastric Adenocarcinoma. PloS One 7: e38892.
6. Nadauld LD, Regan JF, Miotke L, et al. Quantitative and sensitive detection of cancer genome amplifications from formalin fixed paraffin embedded tumors with droplet digital PCR. Transl Med 2012; 2: 107.
7. Nadauld LD, and Ford JM. Molecular Profiling of Gastric Cancer: Toward Personalized Cancer Medicine. J Clin Oncol 2013 March 1; 31(7): 838-839.
8. Parsonnet J, Friedman GD, Vandersteen DP, et al. Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med 1991 Oct 17; 325(16); 1127-1131.
9. Wadhwa R, Song S, Lee JS, et al. Gastric cancer-molecular and clinical dimensions. Nat Rev Clin Oncol 2-13 Nov; 10(11): 643-655.
10. Zouridis H, Deng N, Ivanova T. Methylation subtypes and large-scale epigenetic alterations in gastric cancer. Sci Transl Med 2012 Oct 17; 4(156): 140.
Bình luận ()
Lựa chọn dịch vụ
Quý khách hàng vui lòng lựa chọn dịch vụ y tế theo nhu cầu!