Tin tức
Ung thư đại trực tràng: cơ sở phân tử và điều trị đích
Theo Tổ chức Y tế thế giới, trong năm 2012, trên thế giới có 1,4 triệu người được chẩn đoán bị ung thư đại trực tràng, chiếm 9,7% tổng số các loại ung thư, là loại ung thư phổ biến thứ ba trên thế giới sau ung thư phổi (1,8 triệu, 13%) và ung thư vú (1,7 triệu, 11,9%) [12].
Ung thư đại trực tràng thường bắt đầu từ một polyp u tuyến lành tính, phát triển thành một u tuyến tiến triển với mức độ loạn sản cao và sau đó tiến triển thành ung thư xâm lấn. Ung thư xâm lấn còn giới hạn ở thành đại tràng (các giai đoạn I và II) là có thể chữa được, nhưng nếu không được điều trị, khối u sẽ lan đến các hạch bạch huyết lân cận (giai đoạn III) và sau đó di căn đến các vị trí xa hơn (giai đoạn IV). Các khối u ở giai đoạn I và II có thể chữa được bằng phẫu thuật cắt bỏ và có đến 73% các trường hợp giai đoạn III cũng có thể chữa khỏi bằng phẫu thuật kết hợp với hóa trị liệu. Những tiến bộ gần đây về hóa trị liệu đã cải thiện thời gian sống, tuy nhiên, khi bệnh ở giai đoạn IV thì thường không có khả năng chữa khỏi. Bài viết dưới đây nhằm cung cấp một cái nhìn tổng quan về cơ sở phân tử của ung thư đại trực tràng và về cơ chế phân tử của một số đột biến có thể được dùng làm đích trong điều trị đích (targeted therapy) ung thư đại trực tràng.
1. Cơ sở phân tử của ung thư đại trực tràng
Có nhiều yếu tố liên quan đến sự hình thành khối u trong ung thư đại trực tràng, đó là:
1.1. Sự mất ổn định của bộ gen
Sự mất ổn định của bộ gen có thể dẫn đến sự phát triển của ung thư đại trực tràng thông qua các đột biến liên quan đến khối u. Trong ung thư đại trực tràng, sự bất ổn định của bộ gen có nhiều dạng, mỗi dạng có những nguyên nhân khác nhau.
1.1.1. Sự mất ổn định chiễm sắc thể
Loại phổ biến nhất của sự bất ổn định của bộ gen trong ung thư đại trực tràng là sự mất ổn định của nhiễm sắc thể, gây ra sự thay đổi về số lượng bản sao và cấu trúc của nhiễm sắc thể. Sự mất ổn định nhiễm sắc thể là một cơ chế hiệu quả gây ra tổn hại vật chất của một bản sao hoang dại của các gen ức chế khối u như các gen APC (adenomatous polyposis coli), P53 và thành viên thứ 4 của SMAD của gia đình SMAD (SMAD4), vốn có các hoạt động bình thường chống lại phenotype ác tính. Trong ung thư đại tràng, có rất nhiều đột biến gây bất hoạt các gen vốn có chức năng bình thường để duy trì sự ổn định của nhiễm sắc thể trong quá trình nhân bản và trong tổng hợp. Trái với một số ung thư khác, ung thư đại trực tràng ít liên quan đến khuếch đại số lượng bản sao gen hoặc sắp xếp lại gen.
1.1.2. Những sai sót về sửa chữa ghép cặp DNA
Ở bệnh nhân ung thư đại trực tràng có sự bất hoạt các gen cần thiết để sửa chữa sai lệch ghép cặp base-base của DNA, gọi chung là các gen sai sót sửa chữa ghép cặp. Sự bất hoạt này có thể do di truyền, gặp trong ung thư đại tràng không đa polyp thể di truyền (hereditary nonpolyposis colon cancer: HNPCC), hoặc do mắc phải, như ở các khối u có sự bất hoạt liên quan đến sự methyl hóa của một gen mã hóa một protein sửa chữa sự ghép cặp DNA.
1.1.3. Sự methyl hóa DNA bất thường
Sự bất hoạt của các gen, chủ yếu là qua trung gian bất thường methyl hóa DNA, là một cơ chế bất hoạt gen ở bệnh nhân ung thư đại trực tràng. Ở bộ gen bình thường, sự methyl hóa cytosine xảy ra ở khu vực các trình tự DNA lặp đi lặp lại bên ngoài của exon.Tuy nhiên, ở bộ gen của ung thư đại trực tràng có sự giảm vừa phải sự methyl hóa cytosine nhưng dẫn đến sự methyl hóa bất thường đáng kể ở những đảo CpG liên quan đến promoter. Sự methyl hóa bất thường liên quan đến promoter có thể làm cho sự thể hiện gen (gene expression) không hoạt động.
1.2. Sự bất hoạt do đột biến của các gen ức chế khối u (tumor-suppressor genes)
1.2.1. APC
Trong ung thư đại trực tràng có nhiều thay đổi về gen, đặc biệt là ở các con đường tín hiệu nhất định, là những yếu tố quan trọng trong sự hình thành khối u. Một trong những thay đổi này kích hoạt đường tín hiệu Wnt, được coi là sự mở đầu các sự kiện gây ung thư đại trực tràng. Tín hiệu Wnt xuất hiện khi protein gây ung thư (oncoprotein) β-catenin liên kết với các đối tác của nhân tế bào (các thành viên của gia đình yếu tố tăng cường tế bào lympho của yếu tố tế bào T) tạo nên một yếu tố sao chép để điều hòa các gen có liên quan đến sự hoạt hoá tế bào. Phức hợp β-catenin kiểm soát mức độ protein β-catenin bằng cách phân giải protein. Một thành phần của phức hợp này là APC có vai trò không chỉ giáng hóa β-catenin mà còn ức chế ức chế sự định vị trong nhân tế bào của β-catenin.
Các đột biến trong ung thư đại trực tràng làm bất hoạt gen mã hóa cho protein APC. Trong trường hợp không có chức năng của APC- phanh hãm của β-catenin - tín hiệu Wnt không được kích hoạt một cách thích hợp và liên tục. Các đột biến dòng mầm của APC làm phát sinh bệnh đa polip tuyến gia đình, một hội chứng ung thư có khuynh hướng di truyền trong đó có hơn 100 khối u polyp tuyến có thể phát triển; ở những người mang gen đột biến, nguy cơ ung thư đại trực tràng ở tuổi 40 năm là gần 100%. Các đột biến và những xóa gen thể sôm làm bất hoạt các bản sao của APC có mặt trong hầu hết các u tuyến và các ung thư đại trực tràng ngẫu nhiên. Ở một phân nhóm nhỏ các khối u có APC typ hoang dã, các đột biến của β-catenin làm cho protein kháng phức hợp giáng hóa β-catenin kích hoạt con đường tín hiệu Wnt (Markowitz SD và cộng sự 2009 [6]).
1.2.2. TP53
Sự bất hoạt con đường p53 do đột biến của gen TP53 là bước di truyền then chốt thứ hai trong ung thư đại trực tràng. Trong hầu hết các khối u, hai allel TP53 bị bất hoạt, thường là do sự kết hợp của một đột biến vô nghĩa (missense) làm bất hoạt hoạt động sao chép của gen p53 và một sự xóa chromosom 17b có tác dụng loại trừ allel TP53 thứ hai. Type p53 hoang dã bình thường đóng vai trò làm trung gian cho sự điều hòa chu kỳ tế bào và kiểm soát sự chết của tế bào, có thể được kích hoạt bởi các stress tế bào đa dạng. Sự bất hoạt TP53 thường đi kèm với sự chuyển dạng của u tuyến lớn thành các ung thư xâm lấn.
1.2.3. Con đường ức chế khối u TGF-β
Sự bất hoạt do đột biến của tín hiệu TGF-β (TGF-β tumor-supressor pathway) là bước thứ ba trong cơ chê tiến triển ung thư đại trực tràng. Ở khoảng một phần ba số ung thư đại trực tràng, các đột biến thể sôm làm bất hoạt TGFBR2. Ở các khối u có các khuyết tật sửa chữa ghép cặp, TGFBR2 bị bất hoạt bởi các đột biến dịch khung ở vùng lặp lại của polyadenine trong vùng mã hóa TGFBR2. Ở ít nhất một nửa các ung thư đại trực tràng có sự sai sót sửa chữa ghép cặp type hoang dã, con đường tín hiệu TGF-β bị loại bỏ bởi các đột biến vô nghĩa gây bất hoạt ảnh hưởng đến vùng kinase của TGFBR2 hoặc thường gặp hơn là các đột biến và sự xóa làm bất hoạt các thành phần phía sau SMAD4 của con đường tín hiệu TGF-β hoặc các yếu tố sao chép của nó là SMAD2 và SMAD3. Các đột biến làm bất hoạt con đường TGF-β cũng có tác dụng chuyển đổi từ u tuyến thành sự loạn sản mức độ cao (high-grade dysplasia) hoặc thành ung thư (carcinoma).
1.3. Sự hoạt hóa các con đường sinh ung thư (oncogene pathways)
1.3.1. Các gen RAS và BRAF
Một số gen gây ung thư đóng vai trò quan trọng trong việc thúc đẩy ung thư đại trực tràng. Các đột biến ở RAS và BRAF kích hoạt con đường tín hiệu của protein kinase được kích hoạt bởi phân bào (mitogen-activeted protein kinase: MARK), xảy ra tương ứng ở 37% và 13% số ung thư đại trực tràng. Các đột biến RAS, chủ yếu ở loại KRAS, kích hoạt các GTPase là các tín hiệu trực tiếp đến RAF. Các đột biến BRAF truyền tín hiệu cho hoạt động của BRAF kinase serine-threonine, từ đó điều khiển hơn nữa dòng tín hiệu của MAPK. Các đột biến của BRAF có thể được phát hiện ngay cả ở các khối u nhỏ và so với các đột biến của RAS là phổ biến hơn gặp ở các polyp tăng sản, các u tuyến và ung thư đại tràng. Các bệnh nhân có tổn thương tăng sản nhiều và lớn được gọi là hội chứng đa polype tăng sản (hyperplastic polyposis syndrome), có nguy cơ ung thư đại trực tràng tăng.
1.3.2. Phosphatidylinositol 3-kinase
Một phần ba số ung thư đại trực tràng xuất hiện là do sự kích hoạt của các đột biến thể sôm ở PI3KCA, gen mã hóa cho tiểu đơn vị xúc tác của phosphatidylinositol 3-kinase (PI3K). Sự thay đổi di truyền ít gặp hơn có thể thay thế cho các đột biến PI3KCA bao gồm sự mất PTEN, một chất ức chế của tín hiệu PI3K, cũng như sự khuếch đại cơ chất 2 của thụ thể insulin (insulin receptor substrate 2: IRS2), chất hoạt hóa phía trên của tín hiệu PI3K và sự đồng khuếch đại (coamplification) của AKT và PAK4, là các chất trung gian phía dưới của tín hiệu PI3K.
1.4. Các con đường của yếu tố tăng trưởng (Growth factor pathways)
1.4.1. Sự điều hòa bất thường của tín hiệu prostaglandin
Sự kích hoạt của con đường yếu tố tăng trưởng gặp phổ biến ở ung thư đại trực tràng (Hình 2). Bước đầu quan trọng trong sự phát triển của một u tuyến là sự kích hoạt tín hiệu prostaglandin. Phản ứng bất thường này có thể do viêm hoặc yếu tố phân bào (mitogen) liên quan đến sự điều chỉnh của COX-2, một enzyme cảm ứng trung gian của sự tổng hợp prostaglandin E2, một yếu tố liên quan chặt chẽ với ung thư đại trực tràng. Hoạt động của prostaglandin E2 cũng có thể tăng lên do sự mất của 15- prostaglandin dehydrogenase (15 PGDH), một enzyme xúc tác cho sự giáng hóa của prostaglandin. Sự tăng mức độ của COX-2 được thấy ở khoảng hai phần ba số ung thư đại trực tràng và có mất 15 PGDH ở 80% các u tuyến và ung thư đại trực tràng. Các thử nghiệm lâm sàng đã chỉ ra rằng sự ức chế COX-2 thuốc chống viêm không steroid có tác dụng ngăn cản sự phát triển mới của các u tuyến và làm trung gian cho sự thoái lui của các u tuyến đã được hình thành.
1.4.2. Thụ thể của yếu tố tăng trưởng biểu bì (EGFR)
Yếu tố tăng trưởng biểu bì (Epidermal growth foctor: EGF) là một protein hòa tan có tác dụng dinh dưỡng trên các tế bào ruột (Hình 1). EGFR làm trung gian truyền tín hiệu bằng cách kích hoạt các dòng thác tín hiệu MAPK và PI3K. Các số liệu lâm sàng gần đây đã chỉ ra rằng ung thư đại trực tràng tiến triển có các đột biến thúc đẩy khối u của các con đường này - bao gồm đột biến kích hoạt ở các gen KRAS, BRAF và ở tiểu đơn vị P110 của PI3K - không đáp ứng với điều trị đích chống EGFR.
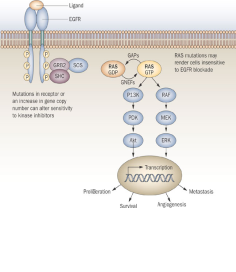
Hình 1. Sơ đồ con đường tín hiệu EGFR (Rasul KI và Kerr DJ, 2009 [8]).
1.4.3.Yếu tố tăng trưởng nội mô mạch máu (VEGF)
Yếu tố tăng trưởng nội mô mạch máu (vascular endothelial growth factor: VEGF) được sản xuất khi chấn thương hoặc trong quá trình phát triển của các mô bình thường, có vai trò điều khiển sự sản xuất các mạch máu mới (angiogenesis). Các nghiên cứu lâm sàng gần đây đã gợi ý về vai trò của con đường tạo mạch trong sự phát triển và khả năng gây tử vong của ung thư đại trực tràng. Việc điều trị đích với kháng thể đơn dòng kháng VEGF bevacizumab đã làm tăng thời gian sống thêm trung bình là 4,7 tháng ở bệnh nhân ung thư đại trực tràng tiến triển (so với với hóa trị liệu). Việc xác định sự khác biệt về phân tử giữa ở những ung thư được điều trị đích và những người không được điều trị này vẫn còn là một thách thức (Markowitz SD và cộng sự 2009 [6]). Một số đột biến có thể được cân nhắc sử dụng trong điều trị đích ung thư đại trực tràng được thể hiện ở bảng 1.
Bảng 1. Một số đột biến có thể được sử dụng trong điều trị đích ung thư đại trực tràng
|
TT |
Gen |
Các đột biến |
Tần suất ung thư đại trực tràng |
Đáp ứng điều trị đích bằng các thuốc |
|
|
Mức độ gen (nucleotides) |
Mức độ protein (aminoacids) |
||||
|
1 |
AKT1 |
c.49G>A |
E17K |
<1–6% |
Hiện chưa rõ |
|
2 |
BRAF |
c.1397G>T c.1406G>C /A/T c.1781A>G/T c.1781A>T c.1786G>C c.1799T>A |
G466V G469A/E/V D594G/V D594V G596R V600E |
8–15% |
Hiện chưa rõ |
|
3 |
KRAS typ hoang dã (Wild Type) |
|
|
60% |
Hiện chưa rõ. Tuy nhiên, gefitinib không tác động ở K đại trực tràng di căn. |
|
4 |
KRAS |
c.34G>T/C/A c.35G>C/A/T c.37G>T/C/A c.38G>C/A/T c.181C>A c.182A>T /G c.183A>C/T c.351A>C /T c.436G>C/A c.437C>T |
G12C /R/S G12A/D/V G13C/R/S G13A/D/V Q61K Q61L/R Q61H/H K117N/N A146P/T A146V |
40% |
Hiện chưa rõ. Tuy nhiên, gefitinib không tác đông ở K đại trực tràng di căn. |
|
5 |
NRAS
|
c.34G>T/A c.34G>A c.35G>C/A/T c.181C>A c.182A>G |
G12C/S G12S G12A/D/V Q61K Q61R |
1-6% |
Hiện chưa rõ |
|
6 |
PIK3CA |
c.1624G>Ac.1633G>A/Cc.1634A>C/G/Tc.1636C>G/Ac.1637A>T/C/Gc.1645G>Ac.3140A>T/G |
E542K E545K/Q E545A/G/V E546E/K E546L/P/R D549N H1047L |
10-30% |
Hiện chưa rõ |
|
7 |
PTEN |
c.477G>Tc.697C>Tc.800delA |
R159S R233* K267fs*9 |
5-14% |
Hiện chưa rõ |
|
8 |
SMAD4 |
c.989A>C c.1051G>C/A c.1065C>A c.1081C>T/A c.1082G>A c.1609G>T |
E330A D351H/N D355E R361C/S R361H D357Y |
10-35% |
Hiện chưa rõ |
1.5. Các con đường của tế bào gốc
Các tế bào gốc ung thư đại trực tràng được cho là có khả năng tự đổi mới. Các tế bào gốc ung thư đại trực tràng có khả năng biến đổi để tạo ra một ung thư di căn. Hiện nay, người ta chưa thể cô lập các tế bào gốc ung thư đại trực tràng của bệnh nhân, mặc dù một số protein bề mặt tế bào nhất định (ví dụ, CD133, CD44, CD166, và aldehyde dehydrogenase 1) là dấu hiệu đầy hứa hẹn. Tế bào gốc bình thường cư trú ở đại tràng dựa trên chất kết dính và tương tác đệm - biểu mô hòa tan để duy trì sự phân chia và biệt hóa. Mức độ thay đổi các cơ chế điều hòa này ở tế bào gốc ung thư đại trực tràng là một lĩnh vực đầy hứa hẹn để nghiên cứu, bởi vì các thuốc kiểm soát sự tăng trưởng của các tế bào gốc ung thư đại trực tràng về lý thuyết có thể được sử dụng để phòng chống và điều trị ung thư.
2. Điều trị đích ung thư đại trực tràng dựa trên sự phát hiện các đột biến gen
Trong hai thập kỷ qua đã có sự công nhận ngày càng tăng về một số đột biến tế bào thân (soma) có thể giúp dự đoán hoặc tiên lượng cho liệu pháp điều trị ung thư đại trực tràng. Những đột biến liên quan đến các gen như KRAS, BRAF, PIK3CA, AKT1, SMAD4, PTEN, NRA và TGFBR2 đã được phát hiện (Baba và cộng sự 2011 [1], Dienstmann et al 2011 [4], Papageorgis et al 2011 [7], Sartore-Bianchi và cộng sự 2009 [9]). Hơn nữa, ngày càng nhiều nhà khoa học công nhận rằng một số gen bị đột biến có thể trở thành đích để phát triển của các thuốc điều trị đích ung thư đại trực tràng (De Roock và cộng sự 2010 [2], De Roock và cộng sự 2011 [3], Huang và cộng sự 2008 [5], Thenappan và cộng sự 2009 [11]). Một số loại thuốc hiện đã được sử dụng trong điều trị đích ung thư đại trực tràng là:
2.1. Điều trị đích chống lại EGFR
EGFR là một phân tử thường xuất hiện với số lượng cao trên bề mặt của tế bào ung thư và giúp chúng phát triển. Các kháng thể đơn dòng Cetuximab (Erbitux ®) và Panitumumab (Vectibix ®) là các chất ức chế các thụ thể của yếu tố tăng trưởng biểu bì (Anti-EGFR TKIs). Cetuximab được sử dụng trong điều trị đích ung thư đại trực tràng di căn, hoặc như là một phần của điều trị ban đầu hoặc sau khi đã điều trị bằng thuốc khác mà không đáp ứng. Panitumumab được sử dụng để điều trị ung thư đại trực tràng di căn, thường là sau khi điều trị khác đã được thử nghiệm.
Khoảng 4/10 số bệnh ung thư đại trực tràng có đột biến ở gen KRAS đã làm cho các loại thuốc này không hiệu quả. Các bác sĩ hiện nay thường kiểm tra các đột biến này và chỉ sử dụng những loại thuốc này ở những người không có đột biến. Các bác sĩ cũng kiểm tra các đột biến ở gen BRAF vì các đột biến này làm các thuốc trên mất tác dụng. Các con đường tín hiệu và vị trí tác động của các thuốc điều trị đích được thể hiện ở Hình 2 (Siena S và cộng sự 2009 [10]).
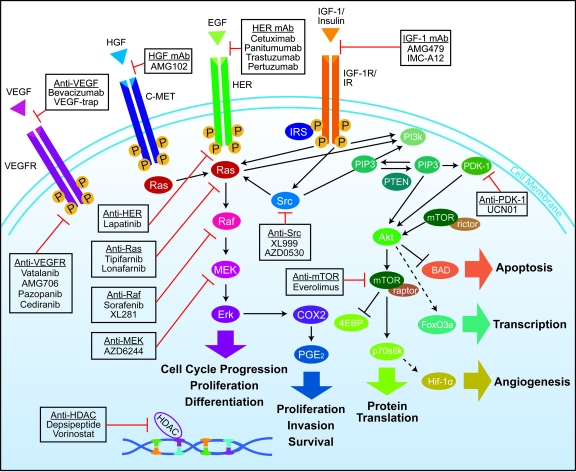
Hình 2. Các con đường tín hiệu và vị trí tác động của các thuốc điều trị đích
2.2. Điều trị đích chống lại VEGF
VEGF là một loại protein giúp các khối u hình thành các mạch máu mới để cơ thể nhận được chất dinh dưỡng (một quá trình được gọi là sự hình thành mạch). Bevacizumab (Avastin ®) và Ziv-aflibercept (Zaltrap ®) là thuốc được sử dụng cho ung thư đại tràng nhắm mục tiêu là ức chế yếu tố tăng trưởng nội mô mạch máu (Anti-VEGF TKIs). evacizumab là một kháng thể đơn dòng thường được kết hợp với hóa trị để điều trị ung thư đại tràng tiến triển.
Ziv-aflibercept (Zaltrap ®) là một loại khác của protein nhắm đích VEGF. Nó cũng có thể được kết hợp với một hóa trị liệu nhất định để điều trị ung thư đại tràng tiến triển.
3.3. Thuốc điều trị đích khác
Kinase là các protein nằm trên hoặc gần bề mặt tế bào có vai trò truyền các tín hiệu quan trọng cho trung tâm điều khiển của tế bào. Regorafenib (Stivarga ®) là một loại thuốc nhắm đích thuộc loại chất ức chế kinase được sử dụng để điều trị đích ung thư đại trực tràng tiến triển. Regorafenib khóa một vài protein kinase có vai trò thúc đẩy tế bào khối u phát triển nhanh hoặc giúp hình thành các mạch máu mới để nuôi khối u. Việc khóa các protein này có thể giúp ngăn chặn sự tăng trưởng của các tế bào ung thư.
Các thuốc ức chế COX-2 (COX-2 inhibitors): COX-2 là một enzyme thuộc con đường tín hiệu prostaglandin đóng một vai trò quan trọng trong sinh bệnh học của ung thư đại trực tràng. COX-2 không thế phát hiện được ở đại tràng bình thường nhưng tăng lên ở 40% các u tuyến và 85% ở ung thư đại trực tràng. Sự thể hiện mạnh của COX-2 là một dấu ấn cho thời gian sống ngắn của của bệnh nhân ung thư đại trực tràng. Các thuốc ức chế COX-2 như celecoxib có tác dụng làm giảm số lượng và kích thước các polyp và có thể ngăn cản sự tiến triển từ polyp tuyến thành ung thư xâm lấn của bệnh đa polyp tuyến gia đinh (FAP).
KẾT LUẬN
1. Có nhiều yếu tố tham gia vào cơ chế bệnh sinh của ung thư đại trực tràng, đó là: sự mất ổn định bộ gen, sự bất hoạt do đột biến của các gen kìm hãm khối u, sự hoạt hóa các con đường của các gen sinh thư, sự đột biến gen ở các con đường của yếu tố sinh trưởng và sự thay đổi hoạt động của tế bào gốc.
2. Hiện nay, một số thuốc ức chế các con đường tín hiệu EGFR, VEGF, tyrosine kinase và sự thể hiện của COX-2 của con đường prostaglandin đã được sử dụng để điều trị đích ung thư đại trực tràng.
TÀI LIỆU THAM KHẢO
1. Baba Y, Nosho K, Shima K, et al. Phosphorylated AKT expression is associated with PIK3CA mutation, low stage, and favorable outcome in 717 colorectal cancers. Cancer 2011 Apr; 117(7): 1399-1408.
2. De Roock W, Claes B, Bernasconi D, et al. Effects of KRAS, BRAF, NRAS, and PIK3CA mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol 2010 Aug; 11(8): 753-762.
3. De Roock W, De Vriendt V, Normanno N, et al. KRAS, BRAF, PIK3CA, and PTEN mutations: implications for targeted therapies in metastatic colorectal cancer. Lancet Oncol 2011 Jun; 12(6): 594-603.
4. Dienstmann R, Vilar E, and Tabernero J. Molecular predictors of response to chemotherapy in colorectal cancer. Cancer J 2011 Mar-Apr; 17(6): 114-126.
5. Huang CH, Mandelker D, Gabelli SB, and Amzel LM. Insights into the oncogenic effects of PIK3CA mutations from the structure of p110alpha/p85alpha. Cell Cycle 2008 May 1; 7(9): 1151-1156.
6. Markowitz SD, and Bertagnolli. Molecular basis of colorectal cancer. N Engl J Med 2009; 361: 2449-2460.
7. Papageorgis P, Cheng K, Ozturk S, et al. Smad4 inactivation promotes malignancy and drug resistance of colon cancer. Cancer Res 2011 Feb 1; 71(3): 998-1008.
8. Rasul KI and Kerr DJ. Targeted therapies: cetuximab plus chemotherapy in patients with advanced NSCLC. Nat Rev Clin Oncol 2009 Sep; 6(9): 499-500.
9. Sartore-Bianchi A, Martini M, Molinari F, et al. PIK3CA mutations in colorectal cancer are associated with clinical resistance to EGFR-targeted monoclonal antibodies. Cancer Res 2009 Mar1; 69(5): 1851-1857.
10. Siena S, Sartore-Bianchi A, Di Nicolantonio F, Balfour J, Bardelli A. Biomarkers predicting clinical outcome of epidermal growth factor receptor-targeted therapy in metastatic colorectal cancer. J Natl Cancer Inst 2009 Oct 7; 101(19): 1308-1324.
11. Thenappan A, Li Y, Shetty K, et al. New Therapeutics Targeting Colon Cancer Stem Cells. Curr Colorectal Cancer Rep 2009 Oct 1; 5(4): 209.
12. World Health Organization 2013. Press Release No. 223. World Cancer Report Dec 2013. Chapter 1: 1.
Bình luận ()
Lựa chọn dịch vụ
Quý khách hàng vui lòng lựa chọn dịch vụ y tế theo nhu cầu!