Tin tức
Ung thư túi mật (GBC): Giá trị của các dấu ấn sinh học trong chẩn đoán, theo dõi và tiên lượng
- 06/12/2021 | Polyp túi mật là gì và polyp túi mật khi nào cần mổ?
- 26/02/2022 | Giải đáp: Sỏi túi mật nên ăn gì và kiêng gì để giảm thiểu triệu chứng
- 16/02/2022 | Bệnh Polyp túi mật - những vấn đề không thể bỏ qua
- 17/04/2022 | Phẫu thuật cắt túi mật có ảnh hưởng đến sức khỏe không?
- 16/03/2022 | Chuyên gia giải đáp: Sỏi túi mật khi nào cần phải mổ?
Tóm tắt
1) Nồng độ CA 19-9, CA125 và CA242 trong huyết thanh ở bệnh nhân ung thư túi mật cao hơn một cách có ý nghĩa so với ở bệnh túi mật lành tính và ở nhóm đối chứng khỏe mạnh. Sự kết hợp các dấu ấn khối u CA 19-9, CA125 và CA242 có thể hữu ích cho chẩn đoán ung thư túi mật.
2) CA 19-9, CA125 và CA242 có giá trị quan trọng trong đánh giá di căn hạch lympho, theo dõi giai đoạn lâm sàng của khối u, hiệu quả điều trị và đánh giá tái phát ung thư túi mật. CA19-9 tốt hơn CEA trong dự đoán mức độ khối u và sự tái phát.
3) Sự kết hợp của CA 19-9, CA125 và CA242 có thể hữu ích để dự đoán tiên lượng; giá trị cắt tối ưu của CA19-9 là 65 U/mL có thể giúp đánh giá tiên lượng ung thư túi mật.
4) Những thay đổi phân tử trong ung thư túi mật gồm những thay đổi ở thụ thể ERBB, con đường PI3K/AKT/mTOR, con đường MAPK, trục VEGF/VEGFR, con đường sửa chữa tổn thương DNA, PD-1 và PD-L1. Các điều trị đích ung thư túi mật gồm các thuốc ức chế EGFR, phong tỏa HER2, các thuốc ức chế đường PI3K/AKT/mTOR, chất ức chế TP53 đột biến, chất ức chế trục VEGF/VEGFR và điều trị miễn dịch.
5) Sinh thiết dịch lỏng dịch mật có thể giúp chẩn đoán ung thư túi mật vì nó có độ nhạy và giá trị dự đoán dương tính cao hơn so với kỹ thuật tế bào học bằng phương pháp nội soi mật tụy ngược dòng; sinh thiết lỏng cũng đang trở thành một công cụ rất hữu ích để theo dõi đáp ứng với điều trị đích và để điều tra sự khởi phát của các đột biến kháng lại điều trị đích.
Gallbladder Cancer (GBC): The value of biomarkers in diagnosis, monitoring and prognosis
Luat Nghiem Nguyen, MEDLATEC General Hospital.
1) Serum levels of CA 19-9, CA125 and CA242 were significantly higher in the gallbladder cancer (GBC) than in the benign gallbladder disease and in healthy control groups. The combination of CA 19-9, CA125 and CA242 may prove to be useful for the diagnosis of gallbladder cancer.
2) CA 19-9, CA125 and CA242 have an important value in the assessment of lymph node metastasis, clinical staging of tumors, therapeutic effects and assessing recurrence of gallbladder cancer. CA19-9 was better than CEA in prediction of tumor burden and in predicting recurrence.
3) The combination of CA 19-9, CA125 and CA242 may be useful for predicting a prognosis; the optimal cutoff value set at 65 U/mL for CA 19-9 may be suggestive in assessing the prognosis of gallbladder cancer.
4) Molecular changes of gallbladder cancer include changes in ERBB receptors, PI3K/AKT/mTOR pathway, MAPK pathway, VEGF/VEGFR axis, DNA damage repair pathway, PD-1 and PD-L1. Targeted therapies for gallbladder cancer include EGFR inhibitors, HER2 blockade, PI3K/AKT/mTOR pathway inhibitors, mutated TP53 inhibitors, VEGF/VEGFR axis inhibitors, and immunotherapy.
5) Liquid biopsy of bile might help us to diagnose gallbladder cancer because of higher sensitivity and positive predict value compared to cytology with endoscopic retrograde cholangiopancreatography, liquid biopsy is also becoming a very useful tool to monitor response to targeted therapies and to investigate the onset of resistance mutations to targeted therapies.
Ung thư đường mật (biliary tract cancers: BTC) là một nhóm các khối u ác tính không đồng nhất gồm ung thư túi mật (gallbladder cancer: GBC), ung thư bóng Vater (ampulla of Vater cancer: AVC) và ung thư biểu mô đường mật (cholangiocarcinoma: CCA). Ung thư biểu mô đường mật (CCA) còn được phân loại thêm thành ung thư biểu mô đường mật trong gan (intrahepatic CCA: iCCA) và ung thư đường mật ngoài gan (extrahepatic CCA: eCCA), trong đó, ung thư đường mật ngoài gan (eCCA) lại được phân thành ung thư biểu mô đường mật vùng rốn gan (perihilar CCA: pCCA) và ung thư biểu mô đường mật xa (distal CCA: dCCA). Tỷ lệ ung thư đường mật (BTC) có sự thay đổi giữa các vùng địa lý khác nhau, ở Châu Á cao hơn ở các nước phương Tây, chiếm 0,6% các ca chẩn đoán ung thư mới trên toàn thế giới. Ung thư túi mật (GBC) là bệnh phổ biến nhất trong số các ung thư đường mật, và là loại ung thư phổ biến thứ sáu của đường tiêu hóa, có tỷ lệ sống sót chung sau 5 năm là khoảng 5%, trở thành bệnh ác tính có tiên lượng kém nhất trong số các ung thư đường mật (BTC) [1, 2].
Các yếu tố nguy cơ gây ung thư túi mật có thể được chia thành bốn loại, gồm: 1) Yếu tố nhân khẩu học: Tuổi cao, giới tính nữ, béo phì, địa lý (Nam Mỹ, Ấn Độ, Pakistan, Nhật Bản và Hàn Quốc), dân tộc (Da trắng, Tây Nam bản địa Mỹ, Mexico và Mỹ), khuynh hướng di truyền; 2) Các bệnh lý và bất thường về túi mật: Sỏi mật, sỏi túi mật, polyp túi mật, nang đường mật bẩm sinh, các bất thường của chức năng tuyến tụy; 3) Sự phơi nhiễm: Kim loại nặng, thuốc (methyldopa, OCP, isoniazid và estrogen, hút thuốc lá; 4) Nhiễm trùng: Salmonella, Helicobacter [4].
Các triệu chứng của ung thư túi mật thường chỉ biểu hiện ở giai đoạn nặng, thường giống như đau quặn mật hoặc viêm túi mật mạn tính, phổ biến nhất là đau hạ sườn phải hoặc thượng vị (54-83%), vàng da (10-46%), buồn nôn và nôn (15-43%), chán ăn (4-41%) và sụt cân (10-39%). Vàng da có thể do khối u xâm lấn trực tiếp vào đường mật hoặc do khối u di căn đến dây chằng gan tá tràng. Chỉ khoảng 3-8% số bệnh nhân ung thư túi mật có khối u có thể sờ thấy được. Trong số những bệnh nhân có biểu hiện triệu chứng, 75% số người có khối u thường tiến triển đến mức độ không thể cắt bỏ được. Ung thư túi mật thường chỉ được chẩn đoán tình cờ nhất khi phẫu thuật túi mật thường quy [4].
Trong bài viết này, giá trị của các dấu ấn khối u như CA19-9, CA242, CEA và CA125 trong huyết thanh trong chẩn đoán, theo dõi và tiên lượng, giá trị của các dấu ấn phân tử được xác định bằng giải trình tự thế hệ mới và giá trị của sinh thiết lỏng trong hướng dẫn điều trị đích ung thư túi mật sẽ được trình bày.
1. Giá trị của các dấu ấn khối u trong chẩn đoán ung thư túi mật
Nồng độ CA19-9, CA242, CEA và CA125 huyết thanh có thể được định lượng bằng kỹ thuật miễn dịch điện hóa phát quang (electrochemiluminescent immunoassay: ECLIA). Các giá trị tham chiếu ở người khỏe mạnh bình thường của một số dấu ấn khối u là: CA19-9 ≤39 U/mL, CEA ≤4 ng/mL, CA242 ≤15 U/mL và CA125 ≤35 U/mL [11].
Không phải tất cả các trường hợp ung thư túi mật đều có sự tăng nồng độ dấu ấn khối u trong huyết thanh bệnh nhân. Tỷ lệ dấu ấn khối u tăng (dương tính) của các dấu ấn khối u CA19-9, CEA, CA125 và CA242, và của sự kết hợp của 4 dấu ấn khối u trong ung thư túi mật được thể hiện ở Bảng 1.
Bảng 1. Tỷ lệ (+) tính của các dấu ấn khối u CA19-9, CEA, CA125 và CA242, và của sự kết hợp của 4 dấu ấn khối u trong ung thư túi mật (Wang YF, 2014 [11]).
|
Dấu ấn khối u |
Ung thư túi mật (n=78) |
Bệnh túi mật lành tính (n=78) |
Người khỏe mạnh bình thường (n=78) |
|
CA19-9 (+) tính (n, %) |
56 (71,7)b |
4 (5,0) |
3 (3,8) |
|
CEA (+) tính (n, %) |
9 (11,5) |
1 (1,2) |
2 (2,5) |
|
CA125 (+) tính (n, %) |
35 (44,8)b |
2 (2,5) |
2 (2,5) |
|
CA242 (+) tính (n, %) |
50 (64,1)b |
2 (2,5) |
1 (1,2) |
|
Sự kết hợp cả 4 dấu ấn (+) tính (n, %) |
7 (8,9) |
0 (0.0) |
0 (0,0) |
Ghi chú: bP <0,01 so với bệnh túi mật lành tính và nhóm đối chứng khỏe mạnh. Sự kết hợp các dấu ấn khối u CA19-9 + CEA + CA125 + CA242.
Bảng 1 cho thấy trong ung thư túi mật, số bệnh nhân có sự tăng CA19-9 và CA242 chỉ chiếm tương ứng là 71,7% và 64,1%, trong khi số bệnh nhân có CEA và CA125 chỉ chiếm tương ứng là 11,5 và 44,8%. Hơn nữa, mức độ tăng của các dấu ấn khối u này còn phụ thuộc và gia đoạn bệnh [11].
Nồng độ của các dấu ấn khối u CA 19-9, CEA, CA125 và CA242 huyết thanh không có sự khác biệt một cách có ý nghĩa giữa nhóm bệnh lành tính (benign disease group) và nhóm đối chứng khỏe mạnh, trong khi mức độ các dấu ấn khối u CA 19-9, CA242 và CA125 trong huyết thanh ở bệnh nhân ung thư túi mật cao hơn một cách có ý nghĩa so với ở nhóm bệnh túi mật lành tính và nhóm đối chứng khỏe mạnh (Bảng 2).
Bảng 2. So sánh nồng độ của các dấu ấn khối u CA19-9, CEA, CA125 và CA242 ở bệnh nhân ung thư túi mật với người bình thường và người bị bệnh túi mật lành tính (Wang YF, 2014 [11])
|
Nhóm |
n |
CEA (μg/L) |
CA19-9 (U/mL) |
CA125 (U/mL) |
CA242 (U/mL) |
|
Đối chứng |
78 |
3,93 ± 2,04 |
14,97 ± 8,91b |
10,48 ± 6,38b |
9,48 ± 3,43b |
|
Bệnh lành tính |
78 |
3,83 ± 1,85 |
15,17 ± 7,82c |
12,99 ± 6,99c |
10,19 ± 3,08c |
|
Ung thư túi mật |
78 |
9,36 ± 3,58 |
238,17 ± 346,36bc |
55,34 ± 81,78bc |
39,92 ± 45,9b |
Ghi chú: các kết quả là nồng độ trung bình ± SD; SD (standard deviation): Độ lệch chuẩn; bP<0,01 là giá trị P của nhóm ung thư túi mật so với nhóm đối chứng; cP<0,05 là giá trị P của nhóm ung thư túi mật so với nhóm bệnh lành tính (benign disease group).
Trong nghiên cứu này [11], nồng độ CEA huyết thanh bệnh nhân ung thư túi mật có tăng so với nhóm đối chứng khỏe mạnh bình thường và nhóm bệnh túi mật lành tính nhưng không có ý nghĩa thống kê.
Giá trị chẩn đoán của một số dấu ấn khối u trong ung thư túi mật được thể hiện ở Bảng 3.
Bảng 3. Giá trị chẩn đoán của một số dấu ấn khối u trong ung thư túi mật (Wang YF, 2014 [11]).
|
Giá trị chẩn đoán |
n |
Độ nhạy |
Độ đặc hiệu |
|
CA19-9 |
56 |
71,7% |
96,1% |
|
CEA |
9 |
11,5% |
97,4% |
|
CA125 |
35 |
44,8% |
96,2% |
|
CA242 |
50 |
64,1% |
98,7% |
Theo Rana S và cộng sự, 2011 [9], giá trị chẩn đoán ung thư túi mật của CA242 có độ nhạy là 64% và độ đặc hiệu là 83%.
Ngoài 4 dấu ấn khối u nêu trên, theo Huang L và cộng sự, 2014 [3], một dấu ấn khối u nữa là CYFRA 21-1 ở giá trị cắt là 3,27 ng/mL cũng có giá trị chẩn đoán ung thư túi mật với độ nhạy 93,7% và độ đặc hiệu 96,2%.
2. Giá trị của các dấu ấn khối u trong theo dõi ung thư túi mật
2.1. Các dấu ấn khối u trong đánh giá giai đoạn bệnh
CA 19-9, CA242 và CA125 thường tăng lên cùng với sự tiến triển của giai đoạn ung thư túi mật. Có sự khác biệt có ý nghĩa thống kê về độ nhạy của bốn dấu ấn khối u giữa các giai đoạn IVA, IVB và II của ung thư túi mật. Độ nhạy của CA 19-9, CA242 và CA125 (nhưng không phải CEA) tăng dần theo sự tiến triển của các giai đoạn bệnh, được đánh giá bằng sự di căn hạch bạch huyết tiến triển (advanced lymph node metastasis: LN).
Trong một nghiên cứu trên 176 bệnh nhân ung thư túi mật, được chia thành ba nhóm gồm nhóm có thể phẫu thuật (resectable) 92 bệnh nhân, nhóm không thể phẫu thuật (unresectable) 17 bệnh nhân và nhóm đã di căn (metastatic) 67 bệnh nhân, Sachan A và cộng sự, 2020 [10] thấy rằng nồng độ CA19-9 huyết thanh ở nhóm bệnh nhân không thể thể phẫu thuật và di căn cao hơn ở nhóm có thể phẫu thuật một cách có ý nghĩa thống kê rất rõ rệt, trong khi sự tăng nồng độ CEA huyết thanh không thể hiện rõ điều này (Bảng 4).
Bảng 4. Nồng độ CA19-9 và CEA huyết thanh trung bình ở ba nhóm bệnh nhân có thể phẫu thuật, không thể phẫu thuật và đã di căn (Sachan A, 2020 [10]).
|
Dấu ấn khối u |
Nhóm 1 (có thể phẫu thuật) |
Nhóm 2 (không thể phẫu thuật) |
Nhóm 3 (di căn) |
P |
|
CA19-9 trung bình (U/mL) |
21,35 |
53,9 |
79 |
< 0,001 |
|
CEA trung bình (ng/mL) |
3,5 |
7,8 |
5,1 |
0,201 |
Trong một nghiên cứu trên 309 bệnh nhân ung thư túi mật, Ma W và cộng sự, 2020 [8] thấy rằng 169 (54,7%) đã được phẫu thuật cắt bỏ R0 (có thể chữa khỏi), trong khi 121 (39,2%) đã được phẫu thuật cắt bỏ R1/2 (không chữa khỏi) và 19 (6,1%) không thể phẫu thuật cắt bỏ. Nồng độ trung bình trong huyết thanh của CEA, CA19-9 và CA19-9 đã điều chỉnh thấp hơn đáng kể ở những bệnh nhân đã được phẫu thuật cắt bỏ R0 so với các nhóm khác. Giá trị cắt tối ưu cho nồng độ CA19-9 đã điều chỉnh là 47,63 U/mL, với độ nhạy là 69,82%, độ đặc hiệu là 75%, giá trị dự đoán dương là 77,12% và giá trị dự đoán âm tính là 67,31%.
Sachan A và cộng sự, 2020 [10] cũng thấy rằng ở các giá trị cắt (cut-off value) của nồng độ CA19-9 là 72 U/mL và CEA là 5 ng/mL, việc đánh giá nguy cơ di căn hạch bạch huyết ở bệnh nhân ung thư túi mật chỉ có độ nhạy và độ đặc hiệu ở mức độ trung bình (Bảng 5).
Bảng 5. Giá trị của CA19-9 và CEA huyết thanh trong đánh giá nguy cơ di căn ở bệnh nhân ung thư túi mật (Sachan A, 2020 [10])
|
Dấu ấn khối u |
Giá trị cắt (cutoff value) |
Độ nhạy |
Độ đặc hiệu |
|
CA19-9 (U/mL) |
72 U/mL |
52% |
80% |
|
CEA (ng/mL) |
5 ng/mL |
51% |
72% |
Như vậy, nồng độ CA19,9 và CEA huyết thanh tăng có thể cho phép dự đoán bệnh di căn ở bệnh nhân ung thư túi mật không vàng da với độ đặc hiệu cao và có thể giúp tiên lượng bệnh nhân. CA19-9 tốt hơn CEA trong dự đoán gánh nặng khối u và dự đoán tái phát.
Về sự tương quan của nồng độ CA 19-9, CA125 và CA242 huyết thanh với sự di căn hạch bạch huyết (LN) trong ung thư túi mật, nghiên cứu của Wang YF và cộng sự, 2014 [11] cũng cho thấy rằng nồng độ CA 19-9, CA125 và CA242 huyết thanh ở bệnh nhân có di căn hạch bạch huyết cao hơn có ý nghĩa so với ở bệnh nhân chưa có di căn. Nồng độ CA 19-9, CA125 và CA242 huyết thanh ở bệnh nhân có di căn hạch bạch huyết ở xa cao hơn có ý nghĩa so với những bệnh nhân có di căn hạch bạch huyết ở liền kề.
Về giá trị của dấu ấn khối u trong dự đoán khả năng có thể phẫu thuật (resectability), trong một nghiên cứu trên 195 bệnh nhân ung thư túi mật, Liu F và cộng sự, 2019 [7] thấy rằng giá trị cắt tốt nhất của nồng độ CA19-9 huyết thanh để dự đoán khả năng có thể phẫu thuật là 98,91 U/mL, tương ứng với độ nhạy, độ đặc hiệu, giá trị dự đoán dương tính và giá trị dự đoán dương tính là 76,3%, 70,8%, 85,7% và 56.5%.
2.2. Giá trị của các dấu ấn khối u trong đánh giá hiệu quả điều trị
Ở những bệnh nhân ung thư túi mật, nếu nồng độ các dấu ấn khối u CA 19-9, CEA, CA125 hoặc CA242 cao trước phẫu thuật, chúng có thể được định lượng theo thời gian sau phẫu thuật để theo dõi và đánh giá đáp ứng đối với điều trị.
Nếu đáp ứng điều trị phẫu thuật cắt bỏ khối u túi mật tốt, nồng độ các dấu ấn này sẽ giảm dần, trở về giới hạn bình thường sau vài tuần lễ.
Nếu nồng độ của một hoặc một số dấu ấn khối u này trong huyết thanh bệnh nhân tăng trở lại sau vài tháng hoặc vài năm sau phẫu thuật, xạ trị, hóa trị liệu hoặc điều trị đích, có thể gợi ý về sự đáp ứng điều trị kém và về nguy cơ tái phát của khối u.
2.3. Giá trị của các dấu ấn khối u trong đánh giá sự tái phát khối u
Theo Sachan A và cộng sự, 2020 [10], mức độ các dấu ấn khối u CA19-9, CA125 và CA242 huyết thanh ở nhóm tái phát cao hơn đáng kể so với nhóm không tái phát 6 tháng sau khi phẫu thuật. Nồng độ CA125, 19-9 và CA242 huyết thanh ở nhóm không tái phát thấp hơn đáng kể so với nhóm GBC trước khi phẫu thuật. Giá trị của CA19-9 và CEA huyết thanh trong dự đoán tái phát ung thư túi mật được thể hiện ở Bảng 6.
Bảng 6. Giá trị của CA19-9 và CEA huyết thanh trong dự đoán tái phát ung thư túi mật (Sachan A, 2020 [10])
|
Thông số |
Tái phát (n) |
Phân tích đơn biến |
Phân tích đa biến |
|||
|
P |
HR (CI) |
P |
HR (CI) |
|||
|
CA19-9 (U/mL) |
< 37 |
21 |
0,013 |
0,293 (0,111-0,770) |
0,020 |
5,803 (1,324-25,440) |
|
>37 |
|
|
|
|
|
|
|
CEA (ng/mL) |
<4 |
11 |
0,040 |
0,352 (0,130-0,954) |
0,906 |
1,093 (0,253-4,725) |
|
> 4 |
19 |
|
|
|
|
|
|
Giai đoạn khối u (T) |
(-) tính |
13 |
0,001 |
10,989 (3,861-31,275) |
0,412 |
2,111 (0,354-12,582) |
|
(+) tính |
25 |
|
|
|
|
|
|
Di căn hạch lympho (LN) |
Không |
12 |
0,001 |
5,667 (2,222-14,451) |
0,484 |
1,874 (0,322-10,904) |
|
Có |
16 |
|
|
|
|
|
3. Giá trị của các dấu ấn khối u trong tiên lượng ung thư túi mật
Theo Sachan A và cộng sự, 2020 [10], thời gian sống thêm trung bình, 3 năm và 5 năm thấp hơn một cách có ý nghĩa ở những bệnh nhân có CA19,9>37 U/mL (P=0,019) và CEA>4 ng/mL (P=0,041), giai đoạn T3/T4 (P=0,001), di căn hạch bạch huyết dương tính (P = 0,001) và sự hiện diện của sự xâm lấn quanh thần kinh (perineural invasion) (P=0,001). Tuy nhiên, trên phân tích đa biến, chỉ có CA19,9>37 U/mL có khả năng dự đoán tái phát (P=0,002, HR 5,8).
Theo Kim M và cộng sự, 2021 [5], giá trị của các dấu ấn khối u CEA, CA19-9 và một số yếu tố đối với tiên lượng sự sống sót chung của bệnh nhân ung thư túi mật dựa trên phân tích đơn biến và đa biến có thể được thể hiện ở Bảng 7.
Bảng 7. Giá trị của các dấu ấn khối u CEA, CA19-9 và một số yếu tố đối với tiên lượng sự sống sót chung của bệnh nhân ung thư túi mật: kết quả phân tích đơn biến và đa biến (Kim M, 2021 [5])
|
Thông số |
Bệnh nhân (n=539) |
Sống sót 2 năm (%) |
Sống sót 5 năm (%) |
P |
Phân tích đa biến |
||
|
HR |
95% CI |
P |
|||||
|
Tuổi (năm) ≤ 60/>60 |
164/375 |
84,9/81,0 |
71,4/67,8 |
<0,001 |
2,245 |
1,562-3,226 |
<0,001 |
|
CEA (ng/mL) ≤ 5/>5 |
500/39 |
84,2/54,9 |
72,1/24,2 |
0,029 |
1,613 |
1,037-2,510 |
0,034 |
|
CA19-9 (U/mL) ≤ 65/>65 |
445/94 |
87,8/55,0 |
76,8/24,0 |
<0,001 |
2,557 |
1,763-3,710 |
<0,001 |
|
Kiểu phẫu thuật đơn giản/ mở |
172/305 |
86,5/84,7 |
69,8/74,4 |
0,004 |
0,567 |
0,399-0,804 |
0,001 |
|
Giai đoạn T1-2/T3-4 |
439/100 |
87,5/57,8 |
75,8/38,0 |
0,015 |
1,752 |
1,162-2,641 |
0,007 |
|
N (hạch) âm tính/dương tính |
395/144 |
89,4/62,5 |
78,7/42,1 |
<0,001 |
2,341 |
1,668-3,287 |
<0,001 |
Ghi chú: HR (hazard ratio): Tỷ số nguy cơ; CI (Confidence interval): Khoảng tin cậy.
Như vậy, sự tăng nồng độ của CA19-9, CA242, CA125 và CEA có giá trị quan trọng trong chẩn đoán, phân giai đoạn lâm sàng, theo dõi sự tái phát, sự di căn, đánh giá hiệu quả điều trị và dự đoán tiên lượng ung thư túi mật. CA 19-9 có sự liên quan mạnh mẽ hơn với tiên lượng so với CEA, và giá trị cắt 65 U/mL của CA 19-9 có thể là gợi ý trong việc đánh giá tiên lượng của ung thư túi mật. Hơn nữa, giá trị cắt 65 U/mL của CA 19-9 cũng có thể là một chỉ số hiệu quả để xác định mức độ phẫu thuật cần thiết và nhu cầu điều trị bổ trợ.
Trong một nghiên cứu trên 390 bệnh nhân ung thư túi mật trong thời gian theo dõi trung bình là 49 (1-123) tháng, ZhijianWen Z và cộng sự, 2017 [12] thấy rằng ở cuối thời gian theo dõi, 327 (84%) bệnh nhân tử vong và 63 (16%) bệnh nhân sống sót. Tất cả bệnh nhân được chia thành ba nhóm theo sự tăng nồng độ các dấu ấn khối u CA19-9 và CEA huyết thanh trước phẫu thuật. Nhóm 1 gồm các bệnh nhân có cả hai dấu ấn khối u trong giới hạn bình thường; nhóm 2 gồm các bệnh nhân chỉ tăng 1 dấu ấn khối u và nhóm 3 gồm các bệnh nhân có sự tăng cả hai dấu ấn khối u. Tỷ lệ sống sót sau phẫu thuật ung thư túi mật dựa trên sự kết hợp của các dấu ấn khối u CA19-9 và CEA trước phẫu thuật được thể hiện ở Bảng 8.
Bảng 8. Tỷ lệ sống sót sau phẫu thuật ung thư túi mật dựa trên sự kết hợp của các dấu ấn khối u CA19-9 và CEA trước phẫu thuật (ZhijianWen Z, 2017 [12])
|
Nhóm bệnh nhân (a) |
n |
Tỷ lệ R0 (%) |
Giá trị P (b) |
Trung bình (Tháng) |
Tỷ lệ sống sót (%) |
So sánh |
Giá trị P (c) |
||
|
1 năm |
3 năm |
5 năm |
|||||||
|
Nhóm 1 (2 dấu ấn bình thường) |
144 |
124 (86) |
|
27 |
66 |
46 |
37 |
1 với 2 |
<0,001 |
|
Nhóm 2 (1 dấu ấn tăng) |
155 |
113 (73) |
<0,001 |
12 |
46 |
17 |
2 |
2 với 3 |
<0,001 |
|
Nhóm 3 (2 dấu ấn tăng) |
91 |
41 (45) |
<0,001 |
6 |
21 |
2 |
0 |
1 với 3 |
<0,001 |
Ghi chú: (a): Tất cả bệnh nhân được chia thành ba nhóm theo các dấu ấn khối u trước phẫu thuật CEA và CA19-9. Nhóm 1: các bệnh nhân có cả hai dấu ấn khối u trong giới hạn bình thường; nhóm 2: các bệnh nhân chỉ tăng 1 dấu ấn khối u; nhóm 3: các bệnh nhân tăng cả hai dấu ấn khối u; (b): Giá trị P khi so sánh tỷ lệ R0 giữa các nhóm; (c): Giá trị P khi so sánh nguy cơ chung giữa các nhóm.
Kết quả cho thấy tỷ lệ sống sót sau phẫu thuật ung thư túi mật dựa trên sự kết hợp của các dấu ấn khối u CA19-9 và CEA trước phẫu thuật càng thấp nếu số lượng các dấu ấn khối u dương tính càng nhiều.
4. Những thay đổi phân tử và điều trị đích ung thư túi mật
4.1. Những thay đổi phân tử trong ung thư túi mật
Ung thư túi mật được đặc trưng bởi những thay đổi bộ gen đặc biệt khác với những thay đổi được quan sát thấy trong các mô học các ung thư đường mật khác. Hầu hết những thay đổi này ảnh hưởng đến các con đường tín hiệu tế bào liên quan đến sự tăng sinh và tồn tại của tế bào, bao gồm các con đường MAPK/ERK, con đường PI3K/Akt/mTOR và bộ máy sửa chữa tổn thương DNA (DNA damage repair: DDR). Một số thay đổi này có liên quan đến lâm sàng và có khả năng điều trị đích với các loại thuốc y học chính xác (precision medicine drugs).
Những thay đổi phân tử có thể điều trị đích trong ung thư túi mật được thể hiện ở Hình 1.
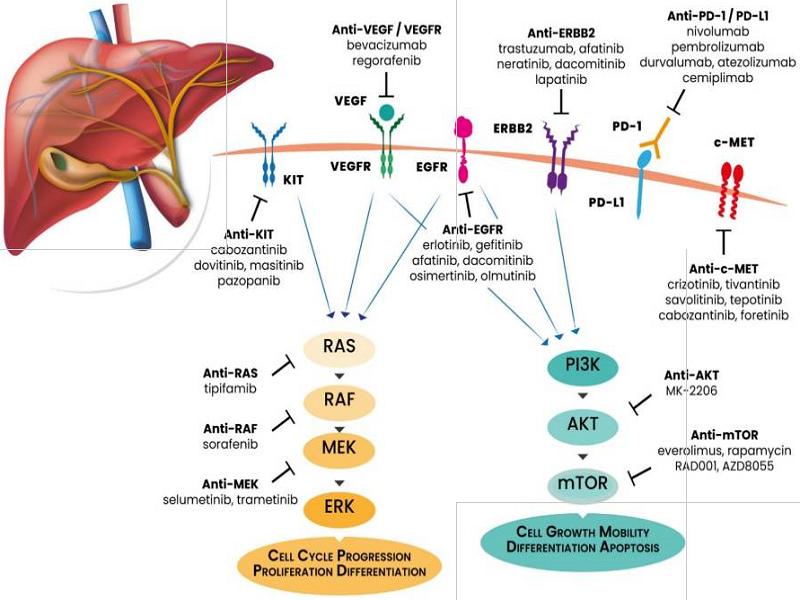
Hình 1. Những thay đổi phân tử có thể có thể điều trị đích của ung thư túi mật. Cell cycle progression: Sự tiến triển của chu trình tế bào; Proliferation: Sự sinh sôi tế bào; Differentiation: sự biệt hóa; Cell growth mobility: hoạt động sinh trưởng tế bào; Apoptosis: sự chết tế bào theo chương trình (Canale M, 2021 [1]).
Trong những năm gần đây, việc tìm kiếm và xác nhận những thay đổi phân tử có thể nhắm đích mới cho y học chính xác, thông qua kỹ thuật Giải trình tự thế hệ tiếp theo (NGS), đã cung cấp một số phương pháp tiếp cận mới để điều trị nhiều loại ung thư, trong đó có ung thư túi mật.
Sự thay đổi phân tử của ung thư túi mật (GBC) chẳng những có sự khác biệt về vị trí giải phẫu so với các ung thư biểu mô đường mật (cholangiocarcinoma: CCA) khác, mà còn có sự khác biệt về chủng tộc. Sự thay đổi bộ gen ở bệnh nhân ung thư túi mật người Trung Quốc và người Hoa Kỳ xảy ra ở gen TP53 tương ứng là 69% và 58%, ở gen CDKN2A/B tương ứng là 26% và 25%. Trong khi người Trung Quốc có sự thay đổi ở các gen ERBB2 (19%), PIK3CA (17%) và CCNE1 (13%), thì ở người Hoa Kỳ có sự thay đổi ở các gen SMAD4 (17%), ARID1A (14%) và PIK3CA (14%) ERBB2 (13%), ...
Những thay đổi phân tử trong ung thư túi mật có thể là những đột biến gen hay những thay đổi phân tử protein ở một số con đường chuyển hóa của khối u, bao gồm:
4.1.1. Các thụ thể ERBB
Các thụ thể ERBB (ERBB receptors) là một họ gồm bốn thành viên (EGFR, HER2, HER3, HER4) của các tyrosine kinase xuyên màng. Sự thay đổi phân tử thụ thể EGFR có thể đóng một vai trò quan trọng trong sự hình thành khối u của ung thư túi mật, vì EGFR thường được thể hiện quá mức trong ung thư đường mật (100% trong ung thư đường mật trong gan, 52,6% trong ung thư đường mật ngoài gan, 38,5% trong ung thư túi mật) và có tương quan với tiên lượng ung thư túi mật. Trong ung thư túi mật, sự biểu hiện quá mức của EGFR được thấy dao động từ 11,3% đến 100%, trong khi các đột biến EGFR chỉ ở khoảng 4%.
4.1.2. Con đường PI3K/AKT/mTOR
Con đường PI3K/AKT/mTOR (PI3K/AKT/mTOR Pathway) được kích hoạt bởi các thụ thể ERBB chịu trách nhiệm kích thích sự tăng sinh và tồn tại của tế bào. Hầu hết các thay đổi phân tử ảnh hưởng đến các đột biến PI3KCA, sự khuếch đại hoặc biểu hiện sai lệch của AKT và mTOR, cũng như đột biến soma ảnh hưởng đến PTEN, ức chế phosphatase của khối u. Những thay đổi phân tử ảnh hưởng đến con đường này được thấy ở 4-16%, trong khi đột biến PTEN được thấy ở 4-51% số bệnh nhân ung thư túi mật, có liên quan đến tiên lượng xấu hơn ở bệnh nhân ung thư túi mật. Con đường PI3K/AKT cũng có thể được kích hoạt bởi SPOCK1, một proteoglycan được biểu hiện cao ở các mô ung thư túi mật và có liên quan đến thời gian sống sót ngắn hơn của bệnh nhân. Fibronectin, một glycoprotein trong dịch mật có nồng độ tăng trong các bệnh đường mật ác tính, cũng có khả năng kích hoạt con đường tín hiệu mTOR.
4.1.3. Con đường MAPK
Con đường MAPK (MAPK Pathway) có liên quan đến quá trình phosphoryl hóa nội bào và có vai trò quan trọng trong sự tăng sinh và tồn tại của tế bào, liên quan đến những yếu tố như KRAS và BRAF, có vai trò trong sinh ung thư và có ý nghĩa đối với liệu pháp. Các đột biến KRAS có tỷ lệ 4-13% ở ung thư túi mật. Một yếu tố kích hoạt tiềm năng khác của cả hai con đường MAPK/ERK và PI3K/AKT là proto-oncogene c-MET. Thụ thể này có thể kích hoạt sự tăng sinh tế bào, chống lại quá trình chết theo chương trình (apoptosis) và sự xâm lấn (invasion). Gen c-MET biểu hiện quá mức ở 39,8% và khuếch đại ở 18,3% các trường hợp. Sự khuếch đại gen c-MET có liên quan đến các đặc điểm bệnh lý lâm sàng hoạt động và tiên lượng xấu.
4.1.4. Sự thay đổi phân tử của VEGF/VEGFR
Yếu tố tăng trưởng nội mô mạch máu (vascular endothelial growth factor: VEGF) là một gia đình gồm năm thành viên là VEGF-A, VEGF-B, VEGF-C, VEGF-D và yếu tố tăng trưởng nhau thai PLGF. Gia đình thụ thể VEGFR (VEGF receptor family) bao gồm VEGFR1, VEGFR2 và VEGFR3 (thụ thể tyrosine kinase), và neuropilin-1 (NP-1) và NP-2 (đồng thụ thể không phải tyrosine kinase). VEGFR-1 đóng vai trò như một mồi nhử cho sự liên kết VEGF-A với VEGFR-2, dẫn đến kích hoạt con đường PI3K/AKT, trong khi việc kích hoạt VEGFR-3 dẫn đến cảm ứng cả hai con đường RAS/MAPK/ERK và PI3K/AKT.
Yếu tố tăng trưởng biểu mô mạch máu và thụ thể VEGF/VEGFR có vai trò tân tạo mạch và tân sinh bạch huyết (VEGF/VEGFR axis guide neo-angiogenesis and neo-lymphangiogenesis), là các quá trình thiết yếu trong sự hình thành khối u túi mật. VEGF huyết thanh tăng có ý nghĩa ở bệnh nhân ung thư túi mật và thúc đẩy quá trình hình thành mạch, tăng sinh và xâm lấn tế bào, nhưng ức chế quá trình chết theo chương trình (apoptosis) ở tế bào ung thư túi mật. Ngoài ra, nồng độ huyết thanh cao và biểu hiện mô của VEGF-C bạch huyết tương quan với biểu hiện mô, di căn hạch và làm giảm thời gian sống sót chung (OS). Tính đa hình (polymorphisms) của gen VEGF với các đột biến 237C>T và 43737830A>G là các yếu tố dự báo nguy cơ mắc bệnh và độ nhạy với ung thư túi mật.
Ngoài ra, sự thay đổi phân tử trong ung thư túi mật cũng có thể xảy ra ở con đường Hedgehog, một con đường đóng một vai trò quan trọng trong các giai đoạn phát triển, thường được tái hoạt trong quá trình ung thư theo con đường đột biến gen hoặc thể hiện quá mức của protein [1].
4.1.5. Sự sửa chữa tổn thương DNA (DDR)
Vai trò của con đường sửa chữa tổn thương DNA (DNA damage repair pathway: DDR) bao gồm các con đường sửa chữa sự cắt bỏ base (base excision repair), sửa chữa sự cắt bỏ nucleotide (nucleotide excision repair: NER), sửa chữa sự đứt sợi đôi (double-strand break repair) và sửa chữa sự ghép cặp không phù hợp (mismatch repair: MMR), để sửa chữa hoặc loại bỏ các tế bào bị tổn thương, giúp ngăn ngừa sự sinh ung thư. Một nghiên cứu trên 760 ca ung thư túi mật cho thấy 14,2% ung thư túi mật có con đường sửa chữa tổn thương (DDR) bị thay đổi và gen ATM thường bị thay đổi nhiều nhất (chiếm khoảng 50% số thay đổi). Sự thay đổi con đường sửa chữa tổn thương (DDR) tương quan với số lượng các đột biến liên quan đến khối u cao hơn.
4.1.6. Sự chết tế bào được lập trình Death-1 (PD-1) và phối tử PD-Ligand 1 (PD-L1)
Thụ thể của sự chết được lập trình (programmed death-1: PD-1) là một thụ thể bề mặt tế bào có chức năng như một điểm kiểm soát tế bào T và đóng vai trò trung tâm trong việc điều chỉnh sự cạn kiệt tế bào T. Sự liên kết của PD-1 với phối tử (ligand) của nó (programmed death-ligand 1: PD-L1), có khả năng kích hoạt các con đường tín hiệu phía dưới và ức chế sự kích hoạt tế bào T. Trong một nghiên cứu trên 83 bệnh nhân ung thư túi mật, người ta thấy rằng biểu hiện dương tính của PD-1 là 51,8% và của PD-L1 15,7%.
4.2. Những tiến bộ trong điều trị đích ung thư túi mật
Y học chính xác (precision medicine) đang trở thành tiêu chuẩn vàng trong nhiều bệnh lý ác tính và việc xác định đặc điểm phân tử khối u cho phép phát hiện, nhắm đích và xác nhận các dấu ấn sinh học mới. Các thử nghiệm lâm sàng nhằm khám phá hiệu quả của các liệu pháp nhắm đích để quản lý lâm sàng ung thư túi mật hiện đang được tiếp tục.
4.2.1. Các chất ức chế EGFR
Các chất ức chế EGFR (EGFR inhibitors) nhắm đích EGFR là một trong những chiến lược phổ biến nhất trong ung thư học lâm sàng. Một số thử nghiệm giai đoạn II trong điều trị ung thư túi mật là sự kết hợp giữa các kháng thể đơn dòng kháng EGFR như cetuximab hoặc panitumumab với các thuốc hóa trị liệu là gemcitabine và oxaliplatin.
4.2.2. Sự phong tỏa HER2
Sự phong tỏa HER2 (HER2 blockade) là một chiến lược khác để điều trị ung thư túi mật. Sự kết hợp điều trị giữa các kháng thể đơn dòng trastuzumab + pertuzumab ở bệnh nhân ung thư đường mật có sự thay đổi HER2 (khuếch đại, biểu hiện quá mức hoặc đột biến) có thể có lợi. Việc điều trị đích HER2 bằng kháng thể đơn dòng trastuzumab ở bệnh nhân ung thư túi mật có thể đạt tỷ lệ kiểm soát bệnh (DCR) là 100% và tỷ lệ đáp ứng khách quan (ORR) là 50%.
4.2.3. Các chất ức chế con đường PI3K/AKT/mTOR
Con đường PI3K/AKT/mTOR (PI3K/AKT/mTOR pathway inhibitors) là một con đường thường bị thay đổi trong ung thư túi mật. Một thử nghiệm giai đoạn I đã phát hiện liều dung nạp tối đa của chất ức chế mTOR everolimus khi kết hợp với gemcitabine, với gemcitabine hoặc với cisplatin trong điều trị ung thư đường mật.
4.2.4. Các chất ức chế gen TP53 bị đột biến
TP53 là gen hay đột biến trong ung thư nói chung cũng như trong ung thư túi mật. Việc điều trị nhắm đích p53 đột biến bằng các chất ức chế gen TP53 đột biến (mutated TP53 inhibitors) đang được nghiên cứu cho ung thư này. Trong một thử nghiệm giai đoạn II trên 20 bệnh nhân ung thư túi mật (15 bệnh nhân có TP53 đột biến), một chất ức chế gen TP53 đột biến là adenovirus oncolytic ONYX-015 đã được sử dụng. Trong số 16 bệnh nhân được điều trị với ONYX-015, 1 bệnh nhân (6,3%) có đáp ứng một phần (partial response: PR), 1 bệnh nhân (6,3%) có thời gian ổn định bệnh kéo dài (49 tuần) và 8 bệnh nhân (50%) có sự giảm >50% dấu ấn khối u.
4.2.5. Các chất ức chế trục VEGF/VEGFR
Các chất ức chế trục VEGF/VEGFR (VEGF/VEGFR axis inhibitors) nhắm đích liên kết VEGF/VEGFR có tiềm năng để điều trị ung thư túi mật. Các kháng thể đơn dòng như bevacizumab và ramucirumab, các phân tử nhỏ như lenvatinib, vandetinib, sorafenib, sunitinib, apatinib và regorafenib đã được chứng minh là có hiệu quả lâm sàng trong nhiều ung thư đường tiêu hóa và ung thư túi mật.
4.2.6. Điều trị miễn dịch đối với ung thư túi mật
Việc điều trị miễn dịch ung thư túi mật (immunotherapy for GBC) bằng các chất ức chế PD-1/PD-L1 hiện đang được thử nghiệm đối với nhiều loại khối u ác tính. Nivolumab (chống PD-1) đã thể hiện hiệu quả điều trị ung thư túi mật trong một số thử nghiệm. Phương pháp điều trị miễn dịch kết hợp với các phân tử chống tạo mạch () cũng đang được nghiên cứu. Durvalumab (một chất chống PD-L1) hiện đang được thử nghiệm giai đoạn I kết hợp hoặc không với tremelimumab (một chất chống CTLA-4). Thời gian đáp ứng trung bình là 9,7 tháng đối với durvalumab đơn trị liệu và 8,5 tháng đối với sự phối hợp với tremelimumab, và thời gian sống sót trung bình (mOS) lần lượt là 8,1 và 10,1 tháng.
5. Sinh thiết lỏng mật và chẩn đoán phân tử ung thư túi mật
Trong một nghiên cứu trên 30 bệnh nhân bị ung thư túi mật, sử dụng tế bào học (cytology) và kỹ thuật giải trình tự thế hệ tiếp theo (next-generation sequencing: NGS), DNA được phân lập từ mật và mô khối u được phân tích để tìm đột biến ở 49 gen sinh ung thư, Kinugasa H và cộng sự, 2018 [6] thấy rằng, 57,1% mẫu DNA từ mô khối u dương tính với đột biến. Ở những bệnh nhân này, 87,5% mẫu DNA khối u tuần hoàn mật (circulating tumor DNA: ctDNA) có cùng đột biến. Tỷ lệ phù hợp giữa ctDNA mật và các mẫu DNA mô là 85,7% và tần số đột biến được phát hiện trong ctDNA gần bằng một nửa tần số được phát hiện trong DNA mô khối u. Mặt khác, độ nhạy của phân tích tế bào học và ctDNA mật lần lượt là 45,8% và 58,3%. Tỷ lệ phù hợp giữa phân tích tế bào bệnh học và ctDNA mật là 87,5%.
Như vậy, DNA khối u đột biến có thể được phát hiện trong dịch mật bằng kỹ thuật giải trình tự thế hệ tiếp theo (NGS). Sinh thiết lỏng dịch mật có thể giúp người thầy thuốc chẩn đoán ung thư túi mật vì độ nhạy và giá trị dự đoán dương tính cao hơn so với kỹ thuật tế bào bệnh học bằng phương pháp nội soi mật tụy ngược dòng (endoscopic retrograde cholangiopancreatography: ERCP).
Tóm lại, nồng độ CA 19-9, CA242 và CA125 huyết thanh cao hơn có ý nghĩa trong ung thư túi mật so với bệnh túi mật lành tính và nhóm đối chứng khỏe mạnh. Sự kết hợp của CA 19-9, CA242 và CA125 có thể hữu ích cho việc chẩn đoán ung thư túi mật. CA125, CA242, và 19-9 có giá trị trong đánh giá giai đoạn bệnh, hiệu quả điều trị và tái phát ung thư túi mật. CA19-9 tốt hơn CEA trong dự đoán giai đoạn bệnh và sự tái phát. Sự kết hợp của CA125, CA242, và 19-9 có thể hữu ích để dự đoán tiên lượng ung thư túi mật. Những thay đổi phân tử trong ung thư túi mật gồm những thay đổi ở thụ thể ERBB, ở con đường PI3K/AKT/mTOR, MAPK, trục VEGF/VEGFR, ở con đường sửa chữa tổn thương DNA, PD-1 và PD-L1. Các thuốc điều trị đích ung thư túi mật có thể gồm các chất ức chế EGFR, phong tỏa HER2, ức chế con đường PI3K/AKT/mTOR, ức chế TP53 đột biến, ức chế trục VEGF/VEGFR và điều trị miễn dịch. Sinh thiết dịch lỏng dịch mật có thể giúp chẩn đoán ung thư túi mật vì nó có độ nhạy và giá trị dự đoán dương tính cao hơn so với kỹ thuật tế bào học, sinh thiết lỏng cũng rất hữu ích để theo dõi đáp ứng điều trị đích và sự khởi phát của các đột biến kháng thuốc đối với các điều trị đích.
Tài liệu tham khảo
1. Canale M, Monti M, Rapposelli IG, et al. Molecular Targets and Emerging Therapies for Advanced Gallbladder Cancer. Cancers (Basel) 2021 Nov; 13(22): 5671.
2. García P, Lamarca A, Díaz J, et al. Current and New Biomarkers for Early Detection, Prognostic Stratification, and Management of Gallbladder Cancer Patients. Cancers (Basel) 2020 Dec; 12(12): 3670.
3. Huang L, Chen W, Liang P, et al. Serum CYFRA 21-1 in Biliary Tract Cancers: A Reliable Biomarker for Gallbladder Carcinoma and Intrahepatic Cholangiocarcinoma. Dig Dis Sci 2014; 60: 1273-1283.
4. Kanthan R, Senger JL, Ahmed S, et al. Gallbladder Cancer in the 21st Century. J Oncol 2015; 2015: 967472.
5. Kim M, Kim H, Han Y, et al. Prognostic Value of Carcinoembryonic Antigen (CEA) and Carbohydrate Antigen 19-9 (CA 19-9) in Gallbladder Cancer; 65 IU/mL of CA 19-9 Is the New Cut-Off Value for Prognosis. Cancers (Basel) 2021 Mar; 13(5): 1089.
6. Kinugasa H, Nouso K, Ako S, et al. Liquid biopsy of bile for the molecular diagnosis of gallbladder cancer. Cancer Biol Ther 2018; 19(10): 934-938.
7. Liu F, Wang JK, Ma WJ, et al. Clinical value of preoperative CA19-9 levels in evaluating resectability of gallbladder carcinoma. ANZ J Surg 2019; 89(3): E76-E80.
8. Ma W, Li W, Wang J, et al. The Clinical Role of Preoperative Serum CA19-9 and Carcinoembryonic Antigen (CEA) Levels in Evaluating the Resectability of Advanced Gallbladder Cancer. Med Sci Monit 2020; 26: e925017-1-e925017-6.
9. Rana S, Dutta U, Kochhar R, et al. Evaluation of CA 242 as a Tumor Marker in Gallbladder Cancer. J Gastrointest Cancer 2011; 43:267-271.
10. Sachan A, Saluja SS, Kumar P, et al. Raised CA19-9 and CEA have prognostic relevance in gallbladder carcinoma. BMC Cancer 2020; 20: 826.
11. Wang YF, Feng FL, Zhao XH, et al. Combined detection tumor markers for diagnosis and prognosis of gallbladder cancer. World J Gastroenterol 2014 Apr 14; 20(14): 4085-4092.
12. Zhijian Wen Z, AnfengSi A, Yang J, et al. Elevation of CA19-9 and CEA is associated with a poor prognosis in patients with resectable gallbladder carcinoma. HPB (Oxford) 2017 Nov; 19(11): 951-956.
Bình luận ()
Lựa chọn dịch vụ
Quý khách hàng vui lòng lựa chọn dịch vụ y tế theo nhu cầu!












