Tin tức
Sự cùng tồn tại HBsAg và anti-HBs ở bệnh nhân viêm gan B mạn: các cơ chế có thể, đặc điểm lâm sàng và xét nghiệm, các biến chứng và điều trị
- 26/10/2022 | Bỏ túi địa chỉ xét nghiệm viêm gan B Mê Linh uy tín, chất lượng cao
- 26/12/2022 | Xét nghiệm viêm gan B bao nhiêu tiền và gợi ý địa chỉ thực hiện
- 14/10/2022 | Test viêm gan B có những phương pháp nào, nên thực hiện ở đâu?
PGS TS Nguyễn Nghiêm Luật
Bệnh viện Đa khoa MEDLATEC
Tóm tắt
1) Định nghĩa: Sự cùng tồn tại kháng nguyên bề mặt viêm gan B (HBsAg) và kháng thể kháng HBsAg (anti-HBs) ở bệnh nhân viêm gan B mạn được xác định bởi sự dương tính đồng thời của cả HBsAg và anti-HBs.
2) Các cơ chế có thể: Các đột biến điểm ở gen preS/S và vùng phiên mã (RT) của gen polymerase, cũng như sự xóa ở vùng preS, tình trạng miễn dịch và yếu tố di truyền của vật chủ, sự tiêm vaccine, sự điều trị kháng virus và ngay cả cả sự nhiễm HBV mạn tính không được điều trị, đều có thể dẫn đến sự cùng tồn tại HBsAg/anti-HBs. Các xét nghiệm mới cũng có thể dẫn đến việc phát hiện các mức độ HBsAg thấp hơn, làm tăng khả năng phát hiện sự cùng tồn tại HBsAg/anti-HBs.
3) Đặc điểm lâm sàng và xét nghiệm: So với bệnh nhân viêm gan B thông thường, bệnh nhân có HBsAg và anti-HBs đồng thời có nồng độ HBsAg, HBV DNA và ALT thấp hơn. Nồng độ HBV RNA, HBV DNA, HBsAg, ALT và AST trong huyết thanh khác nhau đáng kể ở các giai đoạn nhiễm HBV tự nhiên khác nhau. Ở nhóm HBeAg dương tính, nồng độ HBV RNA có sự tương quan thuận với nồng độ HBV DNA và HBsAg, trong khi ở nhóm HBeAg âm tính, nồng độ HBV RNA chỉ tương quan thuận với HBV DNA.
4) Các biến chứng: Sự cùng tồn tại của HBsAg và anti-HBs là bất thường trong nhiễm virus viêm gan B và có liên quan đến các bệnh gan tiến triển, như xơ hóa gan nặng hoặc xơ gan, đặc biệt ở những bệnh nhân có HBeAg âm tính. Nồng độ HBsAg thấp và nồng độ anti-HBs cao cùng tồn tại cũng có thể làm tăng nguy cơ ung thư biểu mô tế bào gan (HCC) ở bệnh nhân viêm gan B mạn tính có tải lượng HBV cao.
5) Điều trị: Sự cùng tồn tại của HBsAg/anti-HBs có thể dẫn đến tình trạng tiến thoái lưỡng nan trong điều trị. Liệu pháp interferon cũng như một số chất tương tự nucleotide (NA) dành riêng cho HBV đã thất bại trong việc đạt được các đáp ứng về virus học. Tuy nhiên, những bệnh nhân nhiễm HBV mạn tính có HBsAg/HBsAb cùng tồn tại có thể được điều trị thành công bằng sự kết hợp của entecavir và tenofovir.
******
HBsAg/anti-HBs coexistence in patients with chronic hepatitis B: possible mechanisms, clinical and laboratory characteristics, complications and treatment
Luat Nghiem Nguyen
MEDLATEC General Hospital
1) Difinition: The coexistence of hepatitis B surface antigen (HBsAg) and antibody against HBsAg (anti-HBs) in patients with chronic hepatitis B was defined by the simultaneous positivity for both HBsAg and anti-HBs.
2) Possible mechanisms: Point mutations in the preS/S gene and the transcriptase (RT) region of polymerase gene, as well as preS deletions, immune status and genetic factor of hosts, vaccination, antiviral therapy, and even the HBV chronic infection without treatment, may all lead to the coexistence of HBsAg/anti-HBs. Novel assays may also lead to the detection of lower HBsAg levels, increasing the detection of the coexistence of HBsAg/anti-HBs.
3) Clinical and laboratory characteristics: Compared with common hepatitis B patients, the patients with coexisting HBsAg and anti-HBs had lower HBsAg, HBV DNA and ALT levels. HBV RNA, HBV DNA, HBsAg, ALT, and AST serum levels were significantly different in different natural phases of HBV infection with statistical significance. In the HBeAg-positive group, HBV RNA levels were positively correlated with HBV DNA and HBsAg levels, while in the HBeAg-negative group, HBV RNA levels were only positively correlated with HBV DNA.
4) Complications: The coexistence of HBsAg and anti-HBs was unusual in patients with chronic hepatitis B and was associated with more advanced liver diseases, such as severe liver fibrosis and cirrhosis, especially among patients with HBeAg negativity. Coexistence of low levels of HBsAg and high levels of anti-HBs may also increase risk of hepatocellular carcinoma (HCC) in chronic hepatitis B patients with high HBV load.
5) Treatment: The coexistence of HBsAg/anti-HBs may lead to a dilemma for treatment. Interferon therapy as well as several nucleotide analogues (NAs) specific for HBV failed to achieve virologic responses. However, chronic HBV-infected patients with coexistence of HBsAg/HBsAb can be successfully treated with a combination of entecavir plus tenofovir.
******
Viêm gan B là bệnh nhiễm virus viêm gan B (hepatitis B virus: HBV), có thể gây viêm gan cấp hoặc mạn tính. HBV thường lây truyền nhất từ mẹ sang con trong khi sinh và khi sinh, cũng như qua tiếp xúc với máu hoặc các chất dịch cơ thể khác bị nhiễm bệnh.
WHO ước tính có 296 triệu người đang sống chung với viêm gan B mạn tính vào năm 2019, với 1,5 triệu ca nhiễm mới mỗi năm. Trong năm 2019, viêm gan B đã gây ra khoảng 820.000 ca tử vong, chủ yếu là do xơ gan (liver cirrhosis: LC) và ung thư biểu mô tế bào gan (hepatocellular carcinoma: HCC). 30,4 triệu người (10,5% số người bị viêm gan B) biết bị nhiễm bệnh và 6,6 triệu người (22%) đã được điều trị.
Mặc dù các thuốc kháng virus hiện đang được sử dụng, gồm các thuốc tương tự nucleos(t)ide (NAs) và interferon-alpha pegylated (Peg-IFN-α)-2a, có thể ức chế hiệu quả sự nhân lên của HBV và sự tiến triển viêm gan B mạn tính (chronic hepatitis B: CHB), DNA vòng khép kín cộng hóa trị (covalently closed circular DNA: cccDNA), một cấu trúc đặc biệt của DNA của virus viêm gan B (HBV), vẫn khó bị loại trừ. Viêm gan B có thể được ngăn ngừa bằng vaccine với hiệu quả từ 98% đến 100%, tỷ lệ trẻ em <5 tuổi bị nhiễm HBV mạn đã giảm xuống dưới 1% vào năm 2019.
Tháng 5 năm 2016, Tổ chức Y tế Thế giới (WHO) đã thông qua Chiến lược Y tế Toàn cầu về bệnh viêm gan virus để loại trừ bệnh viêm gan vào năm 2030 (elimination of hepatitis by 2030) bằng các chiến lược phòng ngừa, chẩn đoán, điều trị và can thiệp cộng đồng [12].
Trong tổng quan này, chúng tôi trình bày về các nguyên nhân có thể, các đặc điểm lâm sàng và xét nghiệm, các biến chứng và điều trị nhiễm HBV mạn cùng tồn tại kháng nguyên HBsAg và kháng thể anti-HBs.
1. Tỷ lệ HBsAg/anti-HBs cùng tồn tại ở bệnh nhân viêm gan mạn
Tỷ lệ HBsAg/anti-HBs cùng tồn tại (coexistence of HBsAg and anti-HBs) còn gọi là HBsAg và anti-HBs cùng dương tính (HBsAg and HBsAb copositive) hay dương tính kép HBsAg/anti-HBs (HBsAg/anti-HBs double positivity) ở bệnh nhân viêm gan mạn được thấy trên thế giới là 1,87% - 7,0% [13], ở Trung Quốc là 2,4% - 5,8%, ở Hoa kỳ là 1,2%, ở Hàn Quốc là 7,0%, ở Pháp là 8,9%, ở Nhật Bản là 20,5% và Singapore là 21% [4].
2. Các cơ chế có thể của HBsAg/anti-HBs cùng tồn tại
Cả mô hình mô phỏng in vitro và mô hình động vật in vivo đều chứng minh rằng kháng nguyên HBsAg và kháng thể anti-HBs của cùng một kiểu huyết thanh (serotypes) không thể cùng tồn tại, nhưng kháng nguyên HBsAg và kháng thể anti-HBs thuộc kiểu huyết thanh khác nhau có thể cùng tồn tại. Nhiễm virus viêm gan B mạn dương tính kép HBsAg/ anti-HBs có thể là do nhiễm virus thuộc các kiểu huyết thanh khác nhau [14].
2.1. Sự đột biến trên bộ gen của HBV
Sự cùng tồn tại của kháng nguyên HBsAg và kháng thể anti-HBs có thể do các đột biến trên bộ gen của HBV gây ra. Các đột biến thường không giới hạn ở các khung đọc mở (open reading frames: ORFs) đặc biệt mà có thể xảy ra ở tất cả các gen của virus và của các yếu tố điều hòa. Tuy nhiên, chúng có xu hướng tập hợp lại với nhau ở các vùng đặc biệt, như ở các gen preS/S, vùng phiên mã ngược (reverse transcriptase region: RT) của gen P (polymerase gene), vùng trước lõi (precore: preC), vùng khởi động lõi cơ bản (basal core promoter: BCP) và ở gen X [4].
2.1.1. Các đột biến gen preS/S
Các đột biến điểm trong gen preS/S đã được nghiên cứu rộng rãi ở các mẫu cùng tồn tại HBsAg/anti-HBs. Vùng ưa nước chính (major hydrophilic region: MHR) của HBsAg bao gồm các vùng quyết định kháng nguyên (epitope) cấu tạo chủ yếu của các hạt virus. Các nghiên cứu in vivo và in vitro cho thấy các thay đổi ở vùng ưa nước chính (MHR) có thể làm thay đổi tính kháng nguyên và khả năng sinh miễn dịch của HBsAg, đồng thời làm giảm đáp ứng của anti-HBs. Người ta đã phát hiện ra rằng tỷ lệ đột biến ở nhóm cùng tồn tại HBsAg/anti-HBs cao hơn 2,7 lần so với nhóm chỉ có HBsAg. Tỷ lệ thay đổi các acid amin ở yếu tố quyết định kháng nguyên “a” của MHR ở nhóm cùng tồn tại HBsAg/anti-HBs cao hơn (9,5% so với 2,4%, P=0,009) so với nhóm chỉ có HBsAg. Tỷ lệ đột biến I126S/T/V ở nhóm cùng tồn tại HBsAg/anti-HBs cao gấp 6 lần so với nhóm chỉ dương tính với HBsAg [4].
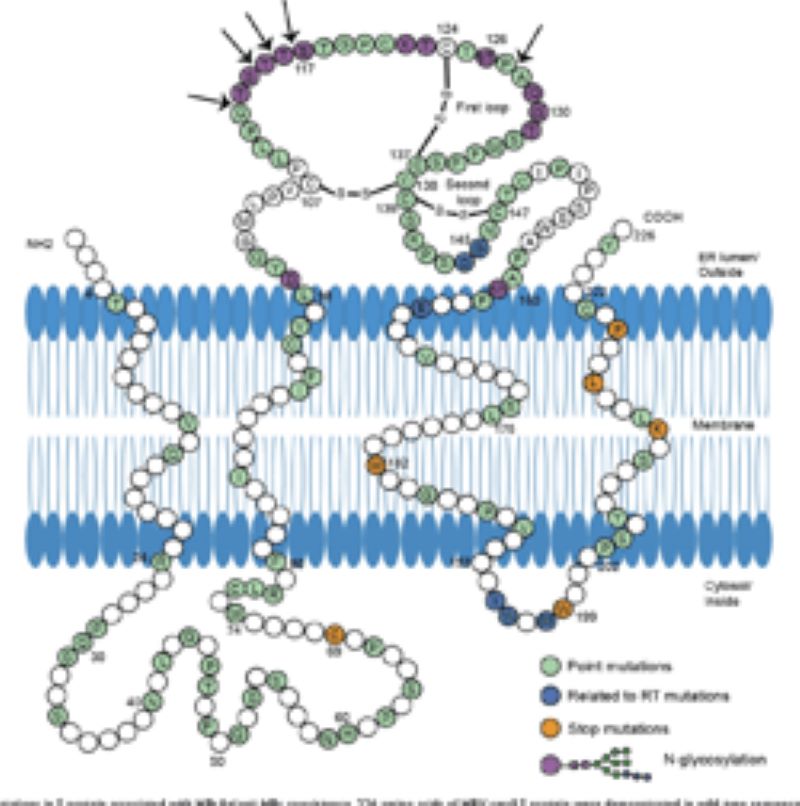
Hình 1. Các đột biến ở protein S liên quan đến cùng tồn tại HBsAg/anti-HBs. Các vị trí màu trắng là các vị trí không có đột biến ở thể cùng tồn tại HBsAg/anti-HBs. Các vị trí màu xanh lá cây là các vị trí xảy ra các đột biến ở tình trạng cùng tồn tại HBsAg/anti-HBs đồng thời riêng lẻ hoặc cùng nhau. Các vị trí màu xanh đậm có liên quan đến đột biến ở vùng phiên mã ngược của gen polymerase. Các đột biến dừng có màu cam và N-glycosyl hóa có màu tím. Các mũi tên chỉ ra các phần chèn vào chuỗi acid amin (Jiang X, 2021 [4]).
Đột biến G145R đã được chấp nhận rộng rãi như là đột biến thoát miễn dịch phổ biến nhất. Các thể có đột biến G145R có thể bị giảm đáng kể ái lực với kháng thể anti-HBs và làm tăng tính chặt chẽ và ổn định của HBsAg bằng cách làm tăng cường độ bền vững của yếu tố quyết định kháng nguyên “a”. Tuy nhiên, tỷ lệ phát hiện G145R là khác nhau ở các kiểu gen khác nhau. Ở kiểu gen C, đột biến G145R ở cả thể cùng tồn tại HBsAg/anti-HBs và ở thể chỉ có HBsAg rất hiếm khi được phát hiện. Ở kiểu gen B, G145R xuất hiện ở nhóm HBsAg/anti-HBs cùng tồn tại nhưng không xuất hiện ở nhóm chỉ có HBsAg. Các đột biến G145R ở kiểu gen B và đột biến I126S/T/V ở kiểu gen C có thể là những thay đổi đặc trưng trên vùng MHR ở thể cùng tồn tại HBsAg/anti-HBs [4].
Quá trình glycosyl hóa, chèn và kết thúc sớm ở protein S ảnh hưởng đến sự biểu hiện, bài tiết và nhận biết HBsAg. Quá trình glycosyl hóa làm giảm ái lực giữa anti-HBs và HBsAg bằng cách làm giảm tính kháng nguyên của HBsAg và làm giảm khả năng trung hòa của anti-HBs. Các vị trí acid amin 129-131 có tỷ lệ N-glycosyl hóa cao nhất.
Sự chèn thêm các N-glycosyl hóa tập trung quanh các vị trí acid amin 112 đến 116 có thể ảnh hưởng đến các đặc tính sinh học và tính kháng nguyên của HBsAg ở mức độ lớn hơn.
Các đột biến dừng W182 và W199 ở miền xuyên màng gần đầu C tận của protein S làm sự tổng hợp HBsAg sớm chấm dứt, làm các kháng thể đặc hiệu không thể nhận biết HBsAg, có thể tạo thuận lợi cho sự nhân lên dai dẳng của virus và làm cho sự tồn tại của HBsAg đột biến kéo dài ngay cả khi có mặt của anti-HBs [1, 2, 4, 7, 8].
2.1.2. Các đột biến ở vùng sao chép ngược của gen P
Các nghiên cứu về hiện tượng cùng tồn tại do đột biến gen polymerase còn hạn chế và chủ yếu tập trung vào vùng sao chép ngược RT (revert transcription) của gen P. Do cấu trúc bộ gen của HBV có sự chồng lấp của gen S và vùng RT của gen P, các đột biến ở gen S có thể dẫn đến những thay đổi ở gen P.
Mức độ thay đổi của các acid amin cao hơn đáng kể ở các vùng RT chồng lên MHR khi so sánh giữa nhóm cùng tồn tại HBsAg/anti-HBs và nhóm chỉ có HBsAg (1,14 so với 0,17, p=0,003). Các đột biến ở vùng RT như rtI16T, rtD134E, rtS135T/Y/N, rtR138N/K, rtN139Q và rtR/W153Q/K/H ở kiểu gen A, B hoặc D xuất hiện thường xuyên hơn rõ rệt ở nhóm cùng tồn tại HBsAg/anti-HBs so với nhóm chỉ có HBsAg (P<0,05). Đột biến kép (dual mutations) rtR153Q ở vùng RT ở gen P và sG145R ở vùng quyết định kháng nguyên “a” của gen S có thể ức chế sự sao chép của HBV bằng cách làm giảm hoạt động polymerase và làm giảm đáng kể khả năng trung hòa của kháng thể anti-HBs bằng cách làm thay đổi khả năng sinh miễn dịch của HBsAg [4].
Việc điều trị bằng các thuốc kháng virus có thể kích thích sự lựa chọn miễn dịch và làm tăng các đột biến của virus. Các đột biến kháng thuốc ở vùng RT của gen P rtL180M và rtM204V xuất hiện ở bệnh nhân điều trị thuốc kháng HBV khi HBsAg/anti-HBs cùng tồn tại được phát hiện lần đầu tiên. Một số đột biến ở vùng RT tương ứng với các đột biến HBsAg bao gồm sE164D, sI195M, sW196S, sM198I và sE164D+sI195M cũng xuất hiện trong quá trình điều trị bằng lamivudine và có thể gặp ở nhóm cùng tồn tại HBsAg/anti-HBs, làm tăng khả năng kháng thuốc và không thể bị vô hiệu hóa bởi kháng thể anti-HBs. Một đột biến kép khác thoát vaccine (vaccine escape mutation) xuất hiện ở thể cùng tồn tại HBsAg/anti-HBs là rtA181T/sW172, có thể dẫn đến việc làm sạch kháng nguyên HBV kiểu dại (wildtype HBV antigen) khỏi huyết thanh, cũng có thể giúp các đột biến thoát vaccine cùng tồn tại với kháng thể kháng HBs do vaccine tạo ra. Mặc dù các đột biến do điều trị gây ra ở các vùng RT không biểu hiện ở tần suất cao ở bệnh nhân cùng tồn tại HBsAg/anti-HBs, nhưng có thể làm thay đổi về hiệu quả của thuốc kháng virus và vaccine [4].
2.1.3. Các đột biến chồng lấp ở gen preC/BCP và gen X
Các đột biến ở vùng khởi động cơ bản BCP (basal core promotor) và vùng trước lõi PC (pre-core) phổ biến trong nhiễm HBV mạn và có liên quan đến mức độ nặng của bệnh gan. Trong quá trình nhiễm HBV, các đột biến điểm G1742A, T1753C, A1755C, T1768A, C1773T, A1775G, T1802C và A1846T có thể xuất hiện ở vùng BCP, trong khi G1896A và G1899A có thể xuất hiện ở vùng PC. Đột biến kép ở vùng BCP là A1762T+G1764A được thấy phổ biến hơn ở những bệnh nhân cùng tồn tại HBsAg/anti-HBs so với những bệnh nhân chỉ có HBsAg (P=0,012). Các đột biến kép có thể làm tăng sự sao mã bộ gen của virus và có thể chống lại sự trung hòa của kháng thể anti-HBs. Đột biến kép A1762T+G1764A ở vùng BCP ở gen P cũng có thể dẫn đến đột biến protein kép K130M+V131I ở protein kháng nguyên HBxAg được mã hóa bởi gen X 36, là đích của lymphocyte độc (cytotoxic lymphocyte: CTL) và có thể làm trung gian cho sự nhận diện miễn dịch của lymphocyte độc. Đột biến và sự dừng sự sinh tổng hợp sớm HBxAg có thể không kích thích hoạt động của lymphocyte độc và có thể làm chậm quá trình thanh thải HBsAg, do đó tạo ra các mẫu huyết thanh học hiếm. Các đột biến ở vùng preC/BCP và ở gen X liên quan đến sự cùng tồn tại HBsAg/anti-HBs hiện mới được báo cáo ở một số mẫu hạn chế, cần được thực hiện nhiều nghiên cứu hơn với cỡ mẫu lớn hơn [1, 4].
2.2. Tình trạng miễn dịch và yếu tố di truyền của vật chủ
Tình trạng miễn dịch bất lợi của vật chủ cũng có thể dẫn đến sự bội nhiễm các chủng HBV khác nhau khi không có đột biến tồn tại ở bộ gen của HBV. Các đột biến hoặc sự kích hoạt lại HBV có thể xảy ra và tạo điều kiện cho HBsAg/anti-HBs cùng tồn tại.
Các yếu tố quyết định phân nhóm HBsAg có các đặc tính vật lý và hóa học đa dạng, và sự lây nhiễm bởi một phân nhóm tạo ra miễn dịch chéo không hoàn toàn, tạo thuận lợi cho sự lây nhiễm hỗn hợp của các phân nhóm khác nhau. Do đó, kháng thể đặc hiệu cho các phân nhóm khác loại trong mẫu huyết thanh học cùng tồn tại thường được tạo ra qua sự lây nhiễm các kiểu huyết thanh HBV khác nhau. Các nhà khoa học Nhật Bản đã phát hiện ra các HBsAg và anti-HBs thuộc các type huyết thanh khác nhau ở những người mang HBV mạn tính. Việc tái nhiễm với type phụ thứ hai có thể là do anti-HB chống lại một type phụ khác với HBsAg đang lưu thông. Trong một thí nghiệm trung hòa, 74,3% (26/35) kháng thể anti-HBs ở những bệnh nhân cùng tồn tại HBsAg/anti-HBs không thể vô hiệu hóa HBsAg huyết thanh của họ và 28,6% (10/35) HBsAg ở cùng một nhóm không thể bị vô hiệu hóa hoàn toàn bởi anti-HBs từ những người đã được tiêm chủng. Kháng thể anti-HBs từ bốn bệnh nhân không thể vô hiệu hóa ba kiểu huyết thanh chính của HBV là adw, adr và ayw. Những kết quả này là bằng chứng cho thấy sự cùng tồn tại HBsAg và anti-HBs có thể sinh ra từ các kiểu huyết thanh khác nhau và sự cùng tồn tại của chúng có thể gây ra mối đe dọa tiềm ẩn đối với cộng đồng nói chung, ngay cả đối với những người đã được tiêm chủng [4, 8].
Sự tái hoạt động (reactivation) của HBV liên quan đến các tình trạng ức chế miễn dịch có thể là một cơ chế khác. Việc phát hiện đồng thời HBsAg và anti-HBs là một dấu hiệu cho thấy có thể có sự tái hoạt động của HBV, xảy ra chủ yếu ở những bệnh nhân đã khỏi HBV do được điều trị bằng hóa trị liệu hoặc ức chế miễn dịch. Bệnh nhân nhiễm HBV đã khỏi thường có HBsAg (-) tính, kháng thể lõi (anti-HBc) (+) tính và kháng thể anti-HBs (+) tính. Người ta thấy sự sao chép của virus hoặc nhiễm HBV tiềm ẩn vẫn có thể xảy ra ở những bệnh nhân này và anti-HBs không có tác dụng bảo vệ chống lại virus. Ở những bệnh nhân có sự tái hoạt động của HBV, sự nhân lên của virus sẽ tăng tốc trở lại để tạo ra một lượng lớn HBsAg trong một thời gian ngắn, dẫn đến tình trạng chung sống và tái hoạt động của HBV liên quan đến điều trị. Sự tái hoạt động của HBV có thể dẫn đến các biến chứng chết người như viêm gan tối cấp (fulminant hepatitis) hoặc suy gan (hepatic failure).
Các yếu tố di truyền của vật chủ cũng có thể đóng một vai trò trong sự thanh thải HBV và ảnh hưởng đến sự xuất hiện của anti-HBs ở những người mang HBsAg mạn. Gen oligoadenylate synthetase 3 (OAS3) của người có thể làm suy giảm lượng RNA của virus và hạn chế sự nhân lên của HBV, điều này có liên quan đến thể HBsAg/anti-HBs cùng tồn tại. Sự biểu hiện quá mức của OAS3 đột biến có thể làm vô hiệu hóa con đường OAS/RNase L do inteferon (IFN) gây ra và làm kháng thể anti-HBs không đủ khả năng thanh thải HBsAg. Điều này cho thấy không thể bỏ qua ảnh hưởng của các yếu tố vật chủ đối với đáp ứng kháng virus [4].
2.3. Ảnh hưởng của phương pháp phân tích
Việc cải thiện các phương pháp chẩn đoán thay cho phương pháp bị lỗi trong phát hiện HBsAg hoặc anti-HBs cũng có thể giải thích cho việc phát hiện sự cùng tồn tại HBsAg/anti-HBs. Trong những năm qua, độ nhạy và độ đặc hiệu của các xét nghiệm đã được cải thiện rất nhiều. Hầu hết các xét nghiệm thương mại để định lượng anti-HBs hiện nay đều đạt được độ chính xác cho các chất chuẩn quốc tế, bao gồm cả xét nghiệm miễn dịch enzym (EIA) và xét nghiệm miễn dịch hóa phát quang (CIA).
Xét nghiệm định tính HBsAg có khả năng phát hiện HBsAg có các đột biến cổ điển ở vùng ưa nước chính (MHR), bao gồm các đột biến điểm ở các vị trí 123, 129, 133, 144, 145 và đột biến kép P142L/S+G145R. Xét nghiệm Architect siêu nhạy để phát hiện HBsAg có thể phát hiện tới 97 đột biến được thiết kế bao gồm các vị trí quan trọng trong protein S. Từ phát hiện định tính đến xác định định lượng, giới hạn của HBsAg đạt đến ranh giới 50 mIU/mL. Hiệu suất chung của xét nghiệm định lượng HBsAg từ các bệnh nhân HBsAg/anti-HBs cùng tồn tại và anti-HBs lưu hành không ảnh hưởng đến việc định lượng HBsAg.
Việc phát triển các xét nghiệm có độ nhạy cao là xu hướng định lượng HBsAg trong tương lai. Một xét nghiệm miễn dịch enzym phát quang hóa học (CLEIA) mới được thiết kế để định lượng HBsAg, sử dụng các kháng thể đơn dòng nhắm vào cả yếu tố quyết định 'a' chung và vòng lặp lại bên trong lớp kép lipid. Độ nhạy của kỹ thuật Lumipulse HBsAg-HQ là 5 mIU/mL, cao hơn khoảng 10 lần so với các xét nghiệm trước đây. Bằng cách phá vỡ các hạt HBV, tách HBsAg khỏi phức hợp HBsAg/anti-HBs, do đó đã biểu lộ hoàn toàn các epitope bên ngoài và bên trong của HBsAg [4].
Cũng cần xử lý tình trạng dương tính giả của HBsAg và anti-HBs do bảo quản, xử lý mẫu, sử dụng thuốc thử vì việc phát hiện có thể bị ảnh hưởng bởi sự nhiễm bẩn, các chất gây nhiễu và lượng huyết tương sử dụng. Việc phát hiện HBsAg và anti-HBs nên được kết hợp với HBV DNA, các dấu ấn chức năng gan và các triệu chứng lâm sàng, làm cơ sở đáng tin cậy cho chẩn đoán và điều trị lâm sàng.
3. Các đặc điểm lâm sàng và xét nghiệm của HBsAg/anti-HBs cùng tồn tại
Trong một nghiên cứu trên 13080 bệnh nhân viêm gan B mạn Liu Y và cộng sự, 2016 [8] thấy có 436 (3,33%) bệnh nhân có HBsAg/Anti-HBs, trong đó 94 bệnh nhân được lựa chọn vào nhóm nghiên cứu và 94 bệnh nhân chỉ có HBsAg được lựa chọn vào nhóm đối chứng. Kết quả nghiên cứu cho thấy tỷ lệ bệnh nhân cùng tồn tại HBsAg/Anti-HBs có nồng độ HBsAg >250 IU/mL, tải lượng virus HBV DNA và hoạt độ ALT đều thấp hơn có ý nghĩa so với nhóm chỉ có HBsAg, tương ứng với giá trị P là < 0,01, 0,001 và < 0,01 (Bảng 1).
Bảng 1. So sánh các đặc điểm lâm sàng và xét nghiệm của các bệnh nhân có HBsAg+/Anti-HBs+ và bệnh nhân chỉ có HBsAg+ (Liu Y, 2016 [8])
|
Các thông số |
Bệnh nhân cùng có HBsAg/Anti-HBs (n=94) |
Bệnh nhân chỉ có HBsAg (n=94) |
Giá trị P |
|
Tuổi (năm) |
56,8 ± 15.9 |
55,1 ± 12,8 |
0,493 |
|
Giới (nam/nữ) |
58/36 |
60/34 |
0,763 |
|
HBsAg > 250 IU/mL |
25/94 (26,6%) |
57/94 (60,6%) |
< 0,01 |
|
HBV DNA (Log10 IU/mL) |
3,36 ± 1,69 |
4,15 ± 1,55 |
0,001 |
|
HBeAg (+) tính |
30/94 (31,9%) |
36/94 (38,3%) |
0,359 |
|
ALT |
23,6 (15,9 - 47,9) |
46,9 (24,6 - 132) |
< 0,01 |
|
HBV Genotype B C D |
23/64 (35,9%) 41/64 (64,1%) 0 |
24/71 (33,8%) 46/71 (64,8%) 1/71 (1,4%) |
0,795 0,930 |
Sự thay đổi các dấu ấn sinh học ở các giai đoạn trong quá trình diễn biến tự nhiên ở các bệnh nhân viêm gan virus B mạn cùng tồn tại HBsAg and anti-HBs được thể hiện ở Bảng 2.
Bảng 2. Sự thay đổi các dấu ấn sinh học ở các giai đoạn trong quá trình diễn biến tự nhiên ở các bệnh nhân viêm gan virus B mạn cùng tồn tại HBsAg/anti-HBs (Xiang Y, 2021 [13])
|
Các giai đoạn lâm sàng |
n |
HBV RNA (Log copies/mL) |
HBV DNA (Log IU/mL) |
HBsAg (IU/mL) |
ALT (U/L) |
AST (U/L) |
|
Dung nạp miễn dịch |
11 |
5,04 (4,61; 5,65) |
7,78 (6,27; 8,23) |
12567,24 (193,27; 25.000,00) |
28 (18; 35) |
21 (20; 31) |
|
Thanh thải miễn dịch |
31 |
2,92 (1,99; 3,84) |
5,58 (5,09; 6,45) |
187,42 (40,49; 1454,56) |
67 (41; 152) |
71 (41; 141) |
|
Ít hoạt động |
15 |
0,00 (0,00; 1,38) |
2,57 (2,34; 2,86) |
62,13 (2,18; 998,41) |
23 (16; 30) |
25 (23; 27) |
|
Tái hoạt động |
33 |
2,68 (0,00; 3,11) |
5,26 (4,10; 6,00) |
687,65 (51,07; 2204,77) |
62 (37; 90) |
60 (37; 83) |
|
Giá trị P |
0,00 |
0,00 |
0,01 |
0,00 |
0,00 |
Các dấu ấn sinh học ở các bệnh nhân viêm gan virus B mạn cùng tồn tại HBsAg/anti-HBs có sự khác nhau giữa nhóm có HBeAg (+) tính và nhóm có HBeAg (-) tính (Bảng 3).
Bảng 3. Sự khác nhau về các dấu ấn sinh học giữa nhóm HBeAg (+) tính và nhóm HBeAg (-) tính các bệnh nhân viêm gan virus B mạn cùng tồn tại HBsAg/anti-HBs (Xiang Y, 2021 [13])
|
Các dấu ấn sinh học |
Nhóm HBeAg (+) tính (n=66) |
Nhóm HBeAg (-) tính (n=83) |
Giá trị P |
|
Tuổi (năm) |
42,09 ± 16,15 |
52,88 ± 14,03 |
0,043 |
|
Nam, n (%) |
40 (60,6%) |
46 (55,42%) |
0,525 |
|
Nữ, n (%) |
26 (39,4%) |
37 (44,58%) |
|
|
HBV RNA (Log IU/mL) |
3,27 (2,24; 4,34) |
1,17 (0,00; 2,80) |
0,000 |
|
HBV DNA (Log IU/mL) |
5,61 (4,88; 6,69) |
3,75 (2,98; 5,00) |
0,000 |
|
HBsAg (IU/mL) |
217,07 (43,72; 8038,54) |
160,41 (18,34; 1444,51) |
0,085 |
|
ALT (U/L) |
39,50 (21,00; 72,00) |
30,00 (20,00; 59,00) |
0,053 |
|
AST (U/L) |
35,00 (21,75; 72,50) |
30,00 (23,00; 60,00) |
0,172 |
Như vậy, các dấu ấn sinh học huyết thanh có sự khác nhau giữa nhóm bệnh nhân viêm gan B mạn cùng tồn tại HBsAg/anti-HBs và nhóm bệnh nhân nhân chỉ có HBsAg (Bảng 1), thay đổi theo các giai đoạn diễn biến tự nhiên của nhiễm virus viêm gan B mạn (Bảng 2) và có sự khác nhau giữa nhóm bệnh nhân có HBeAg (+) tính và nhóm có HBeAg (-) tính.
4. Các biến chứng của nhiễm virus viêm gan B cùng tồn tại HBsAg/anti-HBs
4.1. Sự liên quan giữa sự cùng tồn tại HBsAg/anti-HBs và các bệnh gan tiến triển
Các đột biến liên quan đến các bệnh gan tiến triển ở bệnh nhân nhiễm virus viêm gan B cùng tồn tại HBsAg/anti-HBs có thể gồm:
1) Các đột biến trên gen S (mã hóa cho HBsAg nhỏ), ở vùng ưa nước chính MHR (99-160 aa) có các đột biến điểm và độ biến kép ở kiểu gen B là sT131N+sM133T và ở kiểu gen C gồm sT116N, sQ129N, sT131N, sG130N+sT131N, sG130N+sT131I. Ở vùng MHR cũng có các đột biến cài hoặc đột biến xóa ở kiểu gen C là đột biến chèn ở s112-113 “KNA”, chèn s114-115 “TTN”/”NTSTT”, chèn s115-116 “INGTST”; xóa ở sT113N+ ở 114-116 aa và đột biến dừng ở vùng ngoài MHR ở kiểu gen C là sW182stop.
2) Các đột biến trên gen preS/S (mã hóa cho HBsAg trung bình và lớn) gồm:
- Các đột biến ở vùng preS1 (1-119 aa), gồm các đột biến xóa và dừng, ở kiểu gen B là xóa ở 98-106 aa và ở kiểu gen C là xóa ở 57-117 aa, 66-112 aa, 107-113 aa.
- Các đột biến ở vùng preS2 (120-174 aa) gồm các đột biến xóa và dừng, ở kiểu gen C là xóa ở 125-135 aa, 122-139 aa, 125-138 aa, 132-141 aa và các đột biến ở mã mở đầu ở kiểu gen B là M120I/T/V24.
3) Các đột biến ở gen P (polymerase) gồm các đột biến điểm và đa đột biến ở vùng sao mã ngược RT (1-344 aa), ở kiểu gen B là rtR153Q, rtA181T và ở kiểu gen C gồm rtR153Q, rtA181T, rtM204V, rtL180M+rtM204V, rtV173L+rtL180M+rtM204V.
4) Các đột biến ở gen C:
- Các đột biến ở vùng BCP (1742-1849 nt) và ở gen X (1374-1838 nt) gồm các đột biến ở mức độ nucleotide ở kiểu gen B và C là A1762T+G1764A và ở mức độ protein ở kiểu gen C là G1613A, C1653T, T1674C, T1753 V, G1764A và K130M+V131I.
- Các đột biến ở vùng preC/C (1814-2452 nt) gồm các đột biến điểm và đột biến kép ở kiểu gen B là G1896A+G1899A và ở kiểu gen C là A1846T [4].
Trên lâm sàng, trong một nghiên cứu trên 277 bệnh nhân cùng tồn tại HBsAg và anti-HBs, Wang J và cộng sự, 2022 [10] thấy rằng thể cùng tồn tại HBsAg và anti-HBs có liên quan độc lập với sự xơ hóa gan nặng (severe liver fibrosis) (OR = 2,29; 95% CI, 1,56-3,38; P < 0,001) và xơ gan (cirrhosis) (OR=1,73; 95% CI, 1,12-2,68; P = 0,01) trong một phân tích đa biến. Tuy nhiên, sự liên quan của sự cùng tồn tại HBsAg và anti-HBs với xơ gan chỉ được thấy ở các bệnh nhân có HBeAg âm tính (OR=1,66; 95% CI, 1,05-2,62; P = 0,03) mà không thấy ở các bệnh nhân có HBeAg dương tính (OR=1,45; 95% CI, 0,87-2,43; P = 0,16).
4.2. Sự liên quan giữa thể cùng tồn tại HBsAg/anti-HBs và ung thư biểu mô tế bào gan
Các đột biến về bộ gen ở thể cùng tồn tại HBsAg/anti-HBs có sự liên quan đến nguy cơ ung thư biểu mô tế bào gan (HCC).
1) Các đột biến N-glycosyl hóa của protein S: Các bệnh nhân HCC thể cùng tồn tại HBsAg/anti-HBs có tần suất đột biến N-glycosyl hóa của protein S cao hơn đáng kể so với các bệnh nhân không bị HCC (22,4% so với 8,0%, p<0,01). Quan sát theo chiều dọc cho thấy các đột biến N-glycosyl hóa được phát hiện 1-4 năm trước khi xảy ra HCC, cũng có thể đi kèm các kiểu đột biến khác, như đột biến mất đoạn ở preS và đột biến kép T1762+A1764.
2) Các đột biến xóa ở vùng PreS/S, đặc biệt là ở đầu C tận của preS1 và đầu N của preS2 ở những bệnh nhân cùng tồn tại HBsAg/anti-HBs, có thể ảnh hưởng đến sự nhận biết virus của các tế bào miễn dịch, có thể kích hoạt sự tải nạp tín hiệu phụ thuộc vào protein kinase C (PKC) và tạo ra các yếu tố phiên mã AP-1 và NF-κB, làm tăng sự tăng sinh tế bào gan. Như vậy, các protein đột biến được mã hóa ở vùng preS/S có thể là chất kích hoạt phiên mã, tạo điều kiện thuận lợi cho sự xâm lấn của các khối u. Đột biến ở codon khởi đầu preS2 có thể ảnh hưởng đến quá trình bài tiết của virus và gây ra sự tích tụ protein của virus trong tế bào chủ. Đột biến ở vị trí 120 ở kiểu gen B, sử dụng một con đường khác trong quá trình tiến triển bệnh gan, bao gồm biểu hiện cao của tiểu đơn vị NF-κB p50, có thể kích hoạt NF-κB như một trong những cơ chế gây ra bệnh gan tiến triển. Việc xóa preS1 và preS2 trong tế bào gan được đặc trưng bởi sự lưu giữ bất thường của các protein bề mặt (S) lớn và trung bình đột biến (mutant large and middle surface proteins: LHB và MHB) trong lưới nội bào (endoplasmic reticulum: ER). Việc xóa preS từ các bệnh nhân cùng tồn tại HBsAg/anti-HBs có thể tạo ra các protein bề mặt LHB và MHB bị cắt ngắn. Các thể đột biến cũng có thể bị giữ lại trong lưới nội bào (ER) và tạo ra các tín hiệu stress ER cũng như các phản ứng stress oxy hóa, làm tăng COX-2 và cyclin A để tạo ra sự tiến triển của chu kỳ tế bào và một lượng lớn các thể oxy hoạt động (ROS). Sự mất ổn định bộ gen trong tế bào gan và sự tổn thương tế bào gan kéo dài có thể bắt đầu một phản ứng lập trình được đặc trưng bởi tình trạng viêm, tăng sản tái tạo, hủy bỏ sự điều hòa phiên mã và dị bội. Những tác động này có thể dẫn đến sự phát triển của HCC.
3) Đột biến kép ở vùng BCP của gen C là A1762T+G1764A với tần suất cao hơn rõ rệt ở nhóm cùng tồn tại HBsAg/Anti-HBs so với nhóm chỉ có HBsAg có chức năng như một yếu tố dự báo HCC ở người nhiễm HBV kiểu gen B hoặc C. Đột biến kép này cũng chia sẻ kiểu chung codon 'AGG' của gen p53. Aflatoxin có thể liên kết và gây đột biến ở codon này của gen p53 trong sinh bệnh học của HCC, cho thấy A1762T+G1764A có thể là điểm nóng đột biến (mutational hot spot) do aflatoxin hoặc một số tác nhân hóa học khác nhắm đến [4].
4) Đột biến kép L130M+V131I ở protein HbxAg. Đột biến kép A1762T+G1764A ở vùng BCP của gen C cũng dẫn đến sự đột biến kép L130M+V131I ở protein HBxAg. Protein HBxAg tham gia vào nhiều con đường tín hiệu nội bào, có liên quan chặt chẽ với sự tăng sinh tế bào và quá trình chết theo chương trình (apoptosis) của tế bào và các protein đột biến thể hiện tác dụng gây khối u mạnh hơn so với thể dại. Đột biến kép này có thể đẩy nhanh quá trình xơ hóa gan và xơ gan thông qua việc tạo ra các thể oxy hoạt động (reactive oxygen species: ROS) và phá vỡ ty thể. Sự đóng góp của đột biến kép này đối với HCC có thể là sự tham gia trực tiếp vào quá trình tăng sinh tế bào chủ và quá trình sinh ung thư gan thông qua việc làm thay đổi sự biểu hiện của các gen điều hòa chu trình tế bào. Biến thể có đột biến L130M+V131I cũng có thể tạo ra tác dụng hiệp đồng trong việc đẩy nhanh quá trình tiến triển thành HCC, thúc đẩy sự tiến triển của HCC bằng cách kích hoạt con đường AKT/FOXO1 và gây ra tình trạng viêm nặng hơn ở gan thông qua quá trình chuyển hóa acid arachidonic [4].
Trên lâm sàng, trong một nghiên cứu trên 1.042 bệnh nhân không phải HCC được theo dõi trong thời gian trung bình 4,3 năm (khoảng từ 1,0 đến 22 năm), Seo SI và cộng sự, 2014 [9] thấy rằng tỷ lệ cùng tồn tại của HBsAg/anti-HBs là 7,0% (73/1.042). Trong phân tích đơn biến, tỷ lệ mắc HCC tích lũy trong 5, 10, và 15 năm ở nhóm cùng tồn tại cao hơn đáng kể so với nhóm chỉ có HBsAg (tương ứng với 12,7%, 23,4%, 69,4% so với 4,9%, 13%, 20,6%; P = 0,008). Trong phân tích đa biến, sự cùng tồn tại của HBsAg và anti-HBs có tỷ lệ nguy cơ (HR) là 2,001 (95% CI), 1,023-3,912; P = 0,043) cũng như giới tính nam (HR là 1,898; 95% CI, 0,31-0,896; P = 0,018), tuổi trên 40 (HR là 14,56; 95% CI, 4,499-47,08; P = 0,0001) và xơ gan (HR = 7,995; 95%, 4,756-13,439; P = 0,0001) được xác định là yếu tố độc lập cho sự phát triển của HCC. Ngoài ra, tỷ lệ tích lũy của HCC tăng tỷ lệ thuận với số lượng các yếu tố nguy cơ. Như vậy, sự cùng tồn tại của HBsAg và anti-HBs có thể làm tăng độc lập nguy cơ phát triển HCC trong nhiễm HBV mạn tính. Do đó, cần phải theo dõi sự phát triển của HCC ở những bệnh nhân cùng tồn tại HBsAg và anti-HBs.
Dựa trên việc giải trình tự thế hệ tiếp theo (next-generation sequencing: NGS) và phân tích tin sinh học đa chiều (multidimensional bioinformatics analysis), Wang Y và cộng sự, 2021 [11] thấy rằng các bệnh nhân cùng tồn tại HBsAg/anti-HBs bị viêm gan B mạn (CHB) và bị ung thư biểu mô tế bào gan (HCC) có các kiểu đột biến khác nhau (different mutation patterns). Đặc biệt, các đột biến ở các vùng quyết định kháng nguyên, chẳng hạn như I126S ở CHB và I126T ở bệnh nhân HCC, có thể tác động đến cấu trúc hình dạng và làm thay đổi tính kháng nguyên/khả năng sinh miễn dịch của HBsAg.
Một phân tích đa biến cho thấy nhóm cùng tồn tại HBsAg/anti-HBs có nguy cơ ung thư biểu mô tế bào gan (HCC) cao hơn nhóm đối chứng chỉ có HBsAg 3,08 lần [6]. Thể cùng tồn tại HBsAg/anti-HBs có kháng nguyên HBsAg mức độ thấp và kháng thể anti-HBs mức độ cao có thể là nguy cơ tăng lên của ung thư biểu mô tế bào gan (HCC) ở những bệnh nhân viêm gan B mạn có tải lượng HBV DNA cao [5].
5. Điều trị nhiễm HBV thể cùng tồn tại HBsAg/anti-HBs
Trên lâm sàng, Galati G và cộng sự, 2014 [3] đã thông báo một tình trạng tiến thoái lưỡng nan (dilemma) trong điều trị thể cùng tồn tại HBsAg/anti-HBs. Việc điều trị bằng interferon cũng như bằng một số thuốc tương tự nucleotide (NA) ức chế sự sao mã ngược của gen P (polymarase) như adefovir, adefovir + entecavir đã không đạt được đáp ứng virus học. Chỉ khi kết hợp của các thuốc tương tự nucleotide (NA) thế hệ thứ hai như entecavir + tenofovir, bệnh nhân cuối cùng mới mất HBsAg. Trong một trường hợp khác, sau khi điều trị bằng thuốc kháng virus entecavir trong 8 năm, một bệnh nhân nữ cho thấy hiệu giá kháng thể anti-HBs cao và nồng độ HBsAg ổn định so với 3 năm trước. Mặc dù HBV DNA không thể phát hiện được, nhưng bệnh nhân có nguy cơ tái kích hoạt HBV và việc điều trị tiếp theo trở nên tiến thoái lưỡng nan. HBV DNA bất thường cũng được báo cáo trong các nghiên cứu khác nhau về tình trạng cùng tồn tại HBsAg/anti-HBs. Các thuốc kháng virus có thể làm giảm nồng độ HBV-DNA huyết thanh, che giấu ảnh hưởng của nồng độ HBV DNA huyết thanh đối với sự phát triển của HCC. Trái lại, bệnh nhân cùng tồn tại HBsAg/anti-HBs có tải lượng HBV DNA tương đối cao gợi ý sự nhân lên của HBV đang hoạt động và làm nảy sinh vấn đề lây truyền HBV. Đối với những bệnh nhân cùng tồn tại HBsAg/anti-HBs, tải lượng HBV DNA không đều có thể làm sai lệch quá trình điều trị và đánh giá nguy cơ.
Trong trường hợp HBV đồng nhiễm với một số virus khác, sự cùng tồn tại của HBsAg/anti-HBs có thể làm tăng mức độ phức tạp cho điều trị và tiên lượng xấu. Khoảng 10-15% số người nhiễm virus viêm gan C (hepatitis C virus: HCV) và khoảng 10% số người nhiễm virus gây suy giảm miễn dịch ở người (human immunodeficiency virus: HIV) bị đồng nhiễm với HBV. Trong quá trình đồng nhiễm, tương tác giữa hai loại virus có thể thay đổi lịch sử diễn biến tự nhiên của cả hai loại virus đơn nhiễm. Sự kích hoạt lại HBV có thể xảy ra trong quá trình ức chế miễn dịch do HIV và do việc điều trị bằng thuốc kháng virus tác động trực tiếp liên quan đến HCV, tạo điều kiện cho sự cùng tồn tại HBsAg/anti-HBs.
Trong trường hợp HBV đồng nhiễm với một số bệnh khác như bệnh thấp khớp, sự nhiễm HBV có thể tái hoạt động ở các bệnh nhân bị các bệnh thấp khớp viêm tự miễn (autoimmune inflammatory rheumatic diseases) khi họ sử dụng thuốc ức chế miễn dịch hoặc các liệu pháp sinh học. Sự nhiễm HBV cần được theo dõi và các dấu ấn HBsAg và anti-HBs cần được theo dõi, phát hiện trước và sau khi điều trị các bệnh đồng nhiễm [4].
Tóm lại, sự cùng tồn tại của kháng nguyên HBsAg và kháng thể anti-HBs được xác định bởi sự dương tính đồng thời của cả HBsAg và anti-HBs. Các đột biến điểm ở gen preS/S và vùng phiên mã (RT) của gen polymerase, cũng như sự xóa ở vùng preS, tình trạng miễn dịch và yếu tố di truyền của vật chủ, sự tiêm vaccine, sự điều trị kháng virus và ngay cả cả sự nhiễm HBV mạn tính mà không điều trị, đều có thể dẫn đến đến sự cùng tồn tại HBsAg/anti-HBs. Các xét nghiệm mới cũng có thể dẫn đến việc phát hiện các mức HBsAg thấp hơn, làm tăng khả năng phát hiện sự cùng tồn tại HBsAg/anti-HBs. So với bệnh nhân viêm gan B thông thường, bệnh nhân có HBsAg và anti-HBs đồng thời có nồng độ HBsAg, HBV DNA và ALT thấp hơn. Nồng độ HBV RNA, HBV DNA, HBsAg, ALT và AST huyết thanh khác nhau đáng kể ở các giai đoạn nhiễm HBV tự nhiên khác nhau. Ở nhóm HBeAg dương tính, nồng độ HBV RNA có sự tương quan thuận với nồng độ HBV DNA và HBsAg, trong khi ở nhóm HBeAg âm tính, nồng độ HBV RNA chỉ tương quan thuận với HBV DNA. Sự cùng tồn tại của HBsAg và anti-HBs có thể liên quan đến các bệnh gan tiến triển, như xơ hóa gan nặng hoặc xơ gan, đặc biệt ở những bệnh nhân có HBeAg âm tính. Nồng độ HBsAg thấp và nồng độ anti-HBs cao cùng tồn tại cũng có thể làm tăng nguy cơ ung thư biểu mô tế bào gan (HCC) ở bệnh nhân viêm gan B mạn tính có tải lượng HBV cao. Sự cùng tồn tại của HBsAg và HBsAb ở bệnh nhân viêm gan B mạn tính nói chung khó điều trị nhưng có thể được điều trị thành công bằng sự kết hợp của entecavir và tenofovir.
Tài liệu tham khảo
1. Chen Y, Qian F, Yuan Q, Li X, Wu W, Guo X, Li L. Mutations in hepatitis B virus DNA from patients with coexisting HBsAg and anti-HBs. J Clin Virol 2011 Nov; 52(3):198-203.
2. Colson P, Borentain P, Motte A, Henry M, Moal V, Botta-Fridlund D, Tamalet C, Gérolami R. Clinical and virological significance of the co-existence of HBsAg and anti-HBs antibodies in hepatitis B chronic carriers. Virology 2007 Oct 10; 367(1): 30-40.
3. Galati G, De Vincentis A, Vespasiani-Gentilucci U, Gallo P, Vincenti D, Solmone MC, Dell'Unto C, and Picardi A. Coexistence of HBsAg and HBsAb in a difficult-to-treat chronic hepatitis B: loss of HBsAg with entecavir plus tenofovir combination. BMC Gastroenterol 2014; 14: 94.
4. Jiang X, Chang L, Yan Y, and Wang L. Paradoxical HBsAg and anti-HBs coexistence among Chronic HBV Infections: Causes and Consequences. Int J Biol Sci 2021; 17(4): 1125-1137.
5. Jin ZZ, Jin FJ, Liu X, Liu N, Wen F, and Lou JL. Coexistence of low levels of HBsAg and high levels of anti-HBs may increase risk of hepatocellular carcinoma in chronic hepatitis B patients with high HBV load. Braz J Infect Dis 2019 Sep-Oct; 23(5): 343-351.
6. Kwak MS, Chung GE, Yang JI, and Yim JY. Long-term outcomes of HBsAg/anti-HBs double-positive versus HBsAg single-positive patients with chronic hepatitis B. Sci Rep 2019; 9: 19417.
7. Liu W, Hu T, Wang X, Chen Y, Huang M, Yuan C, and Guan M. Coexistence of hepatitis B surface antigen and anti-HBs in Chinese chronic hepatitis B virus patients relating to genotype C and mutations in the S and P gene reverse transcriptase region. Arch Virol 2012 Apr; 157(4): 627-34.
8. Liu Y, Zhang L, Zhou JY, Pan J, Hu W, and Zhou YH. Clinical and Virological Characteristics of Chronic Hepatitis B Patients with Coexistence of HBsAg and Anti-HBs. PLoS One 2016; 11(1): e0146980.
9. Seo SI, Choi HS, Choi BY, Kim HS, Kim HY, Jang MK. Coexistence of hepatitis B surface antigen and antibody to hepatitis B surface may increase the risk of hepatocellular carcinoma in chronic hepatitis B virus infection: a retrospective cohort study. J Med Virol 2014 Jan; 86(1): 124-130.
10. Wang J, Ding W, Liu J, et al. Association of Coexistent Hepatitis B Surface Antigen and Antibody With Severe Liver Fibrosis and Cirrhosis in Treatment-Naive Patients With Chronic Hepatitis B. JAMA Netw Open 2022 Jun; 5(6): e2216485.
11. Wang Y, Xiao X, Chen S, et al. The Impact of HBV Quasispecies Features on Immune Status in HBsAg+/HBsAb+ Patients With HBV Genotype C Using Next-Generation Sequencing. Front Immunol 2021; 12: 775461.
12. WHO. Hepatitis B. 24 June 2022.
13. Xiang Y, Yang Y, Chen P, Lai X, Shi S, Li S, and You W. Analysis of serum hepatitis B virus RNA levels among HBsAg and HBsAb copositive patients and its correlation with HBV DNA. Medicine (Baltimore) 2021 Oct 8; 100(40): e27433.
14. Zhang Z, Li L, Tian Y, Xia J, Hao Y, Li X, Lu M, Yang D. HBsAg/HBsAb double positive hepatitis B virus infection model in vitro and in vivo. J Huazhong Univ Sci Technolog Med Sci 2009 Oct; 29(5): 575-579.
Bình luận ()
Lựa chọn dịch vụ
Quý khách hàng vui lòng lựa chọn dịch vụ y tế theo nhu cầu!