Bác sĩ: ThS.BSNT Trần Hiền
Chuyên khoa:
Năm kinh nghiệm:
Não người, là trung tâm điều khiển cho tất cả các cơ quan trong cơ thể, là một cơ quan phát triển cao giúp con người thích ứng và chịu đựng các tình huống môi trường khác nhau. Não người cho phép con người thể hiện bản thân qua lời nói, thực hiện các hoạt động, và bày tỏ suy nghĩ và cảm xúc. U não là sự phát triển tế bào não một cách không kiểm soát. Mọi sự phát triển bất thường có thể nhanh chóng ảnh hưởng đến chức năng của não vì hộp sọ người là một cấu trúc cứng và hạn chế thể tích, tùy thuộc vào khu vực của não bị ảnh hưởng. Ngoài ra, u não có thể lan sang các cơ quan khác, làm ảnh hưởng xấu tới các chức năng khác của cơ thể. Phát hiện ung thư sớm giúp có thể lập kế hoạch điều trị hiệu quả. Bài viết sau sẽ trình bày tổng quan về các loại u não nguyên phát, bao gồm đặc điểm phân loại, cơ chế bệnh sinh, và các phương pháp điều trị hiện tại, từ phẫu thuật, xạ trị, hóa trị đến các liệu pháp nhắm trúng đích và miễn dịch.
Các loại u não
U não là thuật ngữ y khoa chỉ sự phát triển bất thường của tế bào não. Tùy thuộc vào vị trí của khối u, loại mô bị ảnh hưởng và liệu nó là ác tính hay lành tính, các nhà khoa học đã phân loại nhiều loại u não dựa trên vị trí của chúng (u nguyên phát hoặc thứ phát) và các yếu tố đóng góp khác. Tổ chức Y tế Thế giới (WHO) phân loại u não thành 120 loại. Phân loại này dựa trên nguồn gốc và tính chất ác tính của tế bào, từ ít ác tính đến rất ác tính. Dưới đây là phân loại WHO 2021 về các khối u của hệ thần kinh trung ương:
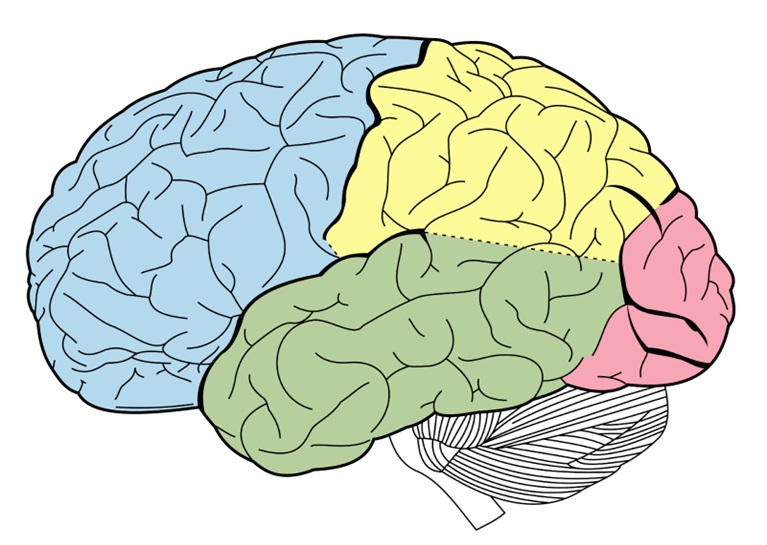
Hình ảnh não bộ với các thuỳ của đại não được tô màu riêng biệt
- U tế bào hình sao, đột biến IDH (WHO độ 2, 3, 4)
- U thần kinh đệm ít nhánh, đột biến IDH, mất đoạn 1p/19q (WHO độ 2, 3)
- U nguyên bào thần kinh đệm, không đột biến IDH (WHO độ 4)
U thần kinh đệm ở trẻ em
- U thần kinh đệm lan tỏa đường giữa, thay đổi H3 K27 (WHO độ 4)
- U thần kinh đệm lan tỏa bán cầu, đột biến H3 G34 (WHO độ 4)
- U thần kinh đệm lan tỏa ở trẻ em loại ác tính cao, không đột biến H3 và IDH (WHO độ 3, 4)
- U thần kinh đệm lan tỏa ở trẻ em loại ác tính thấp (WHO độ 1, 2)
U thần kinh đệm khu trú
- U tế bào hình sao dạng lông (Pilocytic astrocytoma) (WHO độ 1)
- U tế bào hình sao nhầy (Pilomyxoid astrocytoma) (WHO độ 2)
- U tế bào hình sao dạng xanthomatous (Pleomorphic xanthoastrocytoma) (WHO độ 2, 3)
- U tế bào khổng lồ dưới nội tủy (Subependymal giant cell astrocytoma) (WHO độ 1)
U thần kinh đệm ít nhánh và hỗn hợp
- U hạch thần kinh đệm (Ganglioglioma) (WHO độ 1)
- U tế bào thần kinh đệm dạng trẻ sơ sinh (Desmoplastic infantile astrocytoma and ganglioglioma) (WHO độ 1)
- U biểu mô thần kinh loạn sản dạng trẻ sơ sinh (Dysembryoplastic neuroepithelial tumor) (WHO độ 1)
- U thần kinh đệm dạng nhú (Papillary glioneuronal tumor) (WHO độ 1)
- U thần kinh đệm dạng nhầy (Myxoid glioneuronal tumor) (WHO độ 1)
- U thần kinh đệm lan tỏa có đặc điểm giống u thần kinh đệm ít nhánh và cụm nhân (WHO độ 1)
- U thần kinh trung ương (Central neurocytoma) (WHO độ 2)
- U thần kinh trung ương ngoài não thất (Extraventricular neurocytoma) (WHO độ 2)
U nguyên bào thần kinh trung ương và u nguyên bào khác
- U nguyên bào tiểu não, WNT hoạt hóa (WHO độ 4)
- U nguyên bào tiểu não, SHH hoạt hóa và TP53 không đột biến (WHO độ 4)
- U nguyên bào tiểu não, SHH hoạt hóa và TP53 đột biến (WHO độ 4)
- U nguyên bào tiểu não, không thuộc WNT/SHH (WHO độ 4)
- U nguyên bào thần kinh trung ương (Medulloepithelioma) (WHO độ 4)
- U quái không điển hình/rhabdoid (Atypical teratoid/rhabdoid tumor) (WHO độ 4)
- U nguyên bào với hoa hồng đa lớp (Embryonal tumor with multilayered rosettes) (WHO độ 4)
U màng não
- U màng não (WHO độ 1, 2, 3)
- U màng não dạng biểu mô
- U màng não dạng sợi
- U màng não dạng chuyển tiếp
- U màng não dạng mạch máu
- U màng não dạng nang nhỏ
- U màng não dạng vôi hóa
- U màng não tiết dịch
- U màng não giàu tế bào lympho
- U màng não chuyển dạng
- U màng não không điển hình (WHO độ 2)
- U màng não dạng dây (WHO độ 2)
- U màng não dạng tế bào trong (WHO độ 2)
- U màng não dạng nhú (WHO độ 3)
- U màng não dạng rhabdoid (WHO độ 3)
U tuyến tùng
- U tế bào tuyến tùng (Pineocytoma) (WHO độ 1)
- U nguyên bào tuyến tùng (Pineoblastoma) (WHO độ 4)
- U tuyến tùng dạng nhú (Papillary tumor of the pineal region) (WHO độ 2)
U hố yên
- U tuyến yên (Pituitary neuroendocrine tumor, PitNET)
- Ung thư tuyến yên
U nguyên bào mạch máu
- U nguyên bào mạch máu (Hemangioblastoma) (WHO độ 1)
- U sợi đơn độc (Solitary fibrous tumor) (WHO độ 1, 2, 3)
- U chordoma (WHO độ 1, 2, 3)
- U sụn (Chondrosarcoma) (WHO độ 1, 2, 3)
U tế bào thần kinh ngoại biên
- U Schwann (Schwannoma) (WHO độ 1)
- U thần kinh sợi (Neurofibroma) (WHO độ 1)
- U ngoại thần kinh (Perineurioma) (WHO độ 1)
- U ác tính vỏ bao dây thần kinh ngoại biên (Malignant peripheral nerve sheath tumor) (WHO độ 2, 3, 4)
U lympho và u tủy xương di căn lên não
- Lymphoma nguyên phát hệ thần kinh trung ương
- U hạt lympho dạng viêm (Lymphomatoid granulomatosis)
- U tương bào (Plasmacytoma)
- Đa u tủy xương (Multiple myeloma)
- U di căn thứ phát
Dịch tễ học
Mỗi năm, khoảng 85.000 người ở Hoa Kỳ được chẩn đoán mắc u não nguyên phát, trong đó 29% là u ác tính. Khoảng 80–85% các u não nguyên phát ở người lớn thuộc nhóm u nguyên bào thần kinh đệm, loại u xâm lấn rộng rãi vào các mô não.
U nguyên bào thần kinh đệm có tỷ lệ mắc gia tăng sau độ tuổi 40 và đạt đỉnh ở nhóm tuổi 75–84. U nguyên bào thần kinh đệm lan tỏa mức độ thấp thường xảy ra ở bệnh nhân dưới 50 tuổi và được phân loại thêm theo các kiểu phân tử, bao gồm astrocytoma và oligodendroglioma. Các loại u não nguyên phát hiếm gặp khác bao gồm lymphoma nguyên phát hệ thần kinh trung ương (PCNSL), u ác tính của màng não, u màng nội tuỷ, và các loại u hiếm khác.
PCNSL là một biến thể hiếm của u lympho không Hodgkin, xuất hiện trong não, mắt hoặc khoang màng não mà không có dấu hiệu bệnh lý ngoài não. Tỷ lệ mắc PCNSL là khoảng 0,5/100.000 người và tăng ở bệnh nhân trên 60 tuổi. Khoảng 5% u màng thuộc độ 2 của WHO (“không điển hình”), và 1–2% thuộc độ 3 (ác tính). Trong khi đó, u màng nội tuỷ là loại u hiếm gặp xuất hiện ở não, hố sau, và cột sống. Tỷ lệ mắc dao động từ 0,2–0,4/100.000 người, phổ biến hơn ở trẻ em so với người lớn.
Chỉ 5% bệnh nhân mắc u não nguyên phát có tiền sử gia đình mắc u não hoặc các hội chứng ung thư gia đình. Tuy nhiên, phân tích gen dòng sinh dục và phân tích toàn bộ hệ gen cho thấy vai trò của di truyền tương đối lớn trong quá trình hình thành u não. Tiếp xúc trước đó với bức xạ ion hóa của hệ thần kinh trung ương là yếu tố nguy cơ, thường do điều trị ung thư khác như bệnh bạch cầu ở trẻ em.
Tiếp xúc với tia X và nguy cơ u nguyên bào thần kinh đệm
U nguyên bào thần kinh đệm có liên quan đến sự phơi nhiễm tia X, hiện tượng này đã được phát hiện trong quá trình điều trị bệnh nấm da đầu (Tinea capitis) – một bệnh nhiễm nấm phổ biến ở trẻ em. Từ năm 1910 đến 1959, khoảng 200.000 trẻ em trên thế giới đã bị chiếu tia X để điều trị bệnh này theo phương pháp Adamson-Kienbock. Liệu pháp này sử dụng tia X liều thấp chiếu nông vào da đầu, với lớp chì bảo vệ khuôn mặt và cổ. Các nghiên cứu theo dõi dài hạn cho thấy phương pháp này làm tăng nguy cơ mắc u màng não và u thần kinh đệm. Thời gian tiềm ẩn trước khi khối u xuất hiện trung bình là 6 năm, nhưng nguy cơ vẫn tồn tại đến 29 năm sau khi chiếu xạ. Tia X có thể gây nhiều loại tổn thương DNA, bao gồm mất vật liệu di truyền nhiễm sắc thể, đột biến gen và bất thường trong phân bào, góp phần làm tăng nguy cơ u nguyên bào thần kinh đệm.
Hội chứng Li-Fraumeni, U xơ thần kinh type 1, hội chứng Turcot
Hội chứng Li-Fraumeni (LFS) là một rối loạn di truyền hiếm gặp làm tăng nguy cơ ung thư. Phụ nữ mắc hội chứng này có nguy cơ gần 100% mắc ung thư vú trong suốt cuộc đời. Tổng thể, bệnh nhân LFS có nguy cơ mắc một hoặc nhiều loại ung thư lên đến 90%, với 50% khả năng mắc ung thư trước 30 tuổi. Khoảng 9–14% các trường hợp ung thư liên quan đến hội chứng Li-Fraumeni xảy ra trong hệ thần kinh trung ương, chủ yếu là u nguyên bào thần kinh đệm và u sao bào.
U xơ thần kinh type 1 (NF1) là một hội chứng di truyền trội trên nhiễm sắc thể thường, làm tăng nguy cơ ung thư. Bệnh gây ra bởi đột biến trong gene NF1, có vai trò sản xuất neurofibromin – một protein ức chế khối u. Khi gene NF1 bị đột biến, protein neurofibromin trở nên mất chức năng, dẫn đến sự hình thành các u thần kinh bám dọc theo dây thần kinh khắp cơ thể. Mặc dù các khối u xuất hiện trong u xơ thần kinh loại 1 đa số là lành tính, một số bệnh nhân vẫn có nguy cơ mắc u nguyên bào thần kinh đệm cao hơn so với người bình thường.
U xơ thần kinh type 1 là hội chứng di truyền có thể gây u não nguyên phát
Hội chứng Turcot liên quan đến ung thư đại trực tràng di truyền và nguy cơ cao mắc u não nguyên phát. Hội chứng Turcot loại 1 có liên quan đến đột biến trong các gene sửa chữa bắt cặp sai (MMR), còn được gọi là hội chứng Lynch hay ung thư đại trực tràng di truyền không đa polyp (HNPCC). Hội chứng Turcot loại 2 liên quan đến đột biến gene APC, còn được gọi là bệnh đa polyp tuyến có tính gia đình (FAP). Đột biến các gene này có thể dẫn đến u nguyên bào thần kinh đệm hoặc u nguyên bào tủy (medulloblastoma).
Yếu tố nguy cơ do hóa chất
Hiện chưa có bằng chứng rõ ràng nào chứng minh rằng phơi nhiễm hóa chất từ môi trường làm tăng nguy cơ u nguyên bào thần kinh đệm ở người. Thách thức lớn nhất trong nghiên cứu dịch tễ học là tỷ lệ mắc u nguyên bào thần kinh đệm rất thấp, khiến việc thu thập dữ liệu trở nên khó khăn.
Đa số các nghiên cứu hiện tại chỉ đánh giá nguy cơ dựa trên nghề nghiệp hoặc vị trí địa lý của bệnh nhân. Tuy nhiên, mức độ tiếp xúc với hóa chất có thể thay đổi đáng kể ngay cả giữa những người sống gần nhau. Do đó, dữ liệu về phơi nhiễm hóa chất chưa đủ chính xác để đưa ra kết luận chắc chắn. Một số tác nhân hóa trị, bao gồm temozolomide (TMZ), có thể gây ra kiểu đột biến quá mức, làm tăng nguy cơ đột biến của u nguyên bào thần kinh đệm tái phát và làm khối u trở nên kháng điều trị hơn.
Khoảng 50% bệnh nhân u não nguyên phát đầu tiên biểu hiện đau đầu. Các triệu chứng như buồn nôn, nôn mửa và mệt mỏi lâu dài có thể là do tăng áp lực nội sọ, nhất là ở những bệnh nhân có khối u tiến triển nhanh. Khám thực thể trong những trường hợp này có thể phát hiện phù gai thị. Tăng áp lực nội sọ tạm thời có thể gây mất ý thức theo từng đợt và có thể bị nhầm với cơn động kinh. Bệnh nhân có thể xuất hiện các dấu hiệu thần kinh khu trú liên quan đến vị trí của khối u. Ví dụ, các khối u ảnh hưởng đến thùy trán (24%) có thể gây thiếu sáng tạo và khó khăn trong việc xử lý thông tin và phản ứng thích hợp với môi trường. Các khối u ở bán cầu ưu thế có thể biểu hiện bằng khó khăn trong phát âm, trong khi các khối u ở bán cầu không ưu thế có thể có các triệu chứng tinh tế hơn như rối loạn nhận cảm không gian. Các bệnh lý thần kinh sọ do sự lan tỏa của ung thư vào màng não hoặc tăng áp lực nội sọ có thể biểu hiện với các liệt mắt, mất thính lực hoặc khó nuốt. Các triệu chứng có thể xuất hiện trong vài tuần đến vài tháng. Có tới 74% bệnh nhân u thần kinh đệm độ thấp xuất hiện cơn động kinh, nhưng các khối u có thể tồn tại trong nhiều năm trước khi triệu chứng xuất hiện hoặc chỉ có thể được phát hiện tình cờ. U lympho nguyên phát thần kinh trung ương chủ yếu ảnh hưởng đến các cấu trúc trong các phần não sâu và nhiều bệnh nhân (lên tới 40%) có sự thay đổi hành vi hoặc nhận thức.
Đau đầu là triệu chứng cơ năng phổ biến trong u não nguyên phát
Một số đặc điểm, triệu chứng lâm sàng xuất hiện liên quan đến vị trí khối u chèn ép tổ chức não, bao gồm:
- Thể chai: suy giảm nhận thức, giảm tập trung, suy giảm trí nhớ, thay đổi tính cách, mệt mỏi
- Hố yên: Bán manh hai thái dương, đau đầu, giảm/tăng cân không rõ nguyên nhân, rụng tóc, rối loạn kinh nguyệt, rối loạn chức năng tình dục
- Đồi thị: Thiếu hụt cảm giác đối bên, đau đầu, mất ngôn ngữ
- Thùy trán: Thiếu hụt vận động đối bên, thay đổi tính cách, suy giảm nhận thức và chức năng điều hành
- Bán cầu chiếm ưu thế: mất khả năng tiếp nhận và diễn đạt ngôn ngữ, nhầm lẫn trái - phải, mất khả năng tính toán, mất khả năng viết, mất nhận thức
- Thùy đỉnh: Thiếu hụt cảm giác đối bên, bán manh một phần góc phần tư dưới đối bên
- Bán cầu không chiếm ưu thế: giảm khả năng suy luận không gian, bỏ qua không gian đối bên, mất khả năng xây dựng hình ảnh, mất nhận thức bệnh, giảm khả năng cảm nhận âm nhạc, nhận biết tông giọng
- Thùy chẩm: Thiếu hụt trường thị giác đồng danh đối bên
- Thùy thái dương: Rối loạn nhận thức thính giác, suy giảm trí nhớ, co giật, bán manh một phần góc phần tư trên đối bên
- Thân não: Song thị, liệt mặt, khó nuốt, yếu liệt tứ chi, rối loạn dáng đi, buồn nôn, nôn mửa, đau đầu
- Tiểu não: Mất điều hòa vận động cùng bên, rối loạn phối hợp, cử động mắt không kiểm soát, buồn nôn, nôn mửa, chóng mặt
Chụp cộng hưởng từ (MRI) có tiêm thuốc cản quang là phương pháp chẩn đoán hình ảnh được ưu tiên lựa chọn khi nghi ngờ có khối u ở não, tốt nhất nên sử dụng giao thức chụp MRI tiêu chuẩn cho u não. U nguyên bào thần kinh đệm thường có hình ảnh tăng bắt thuốc trên xung T1, hoại tử trung tâm, phù não tăng tín hiệu trên xung T2, và hình ảnh hiệu ứng khối. U thần kinh đệm bậc thấp thường giảm tín hiệu trên T1 và tăng tín hiệu trên T2. U lympho nguyên phát hệ thần kinh trung ương có thể đa ổ và thường biểu hiện tăng bắt thuốc đồng nhất. U màng não (meningioma) thường có bắt thuốc đồng nhất và dày màng cứng lân cận.
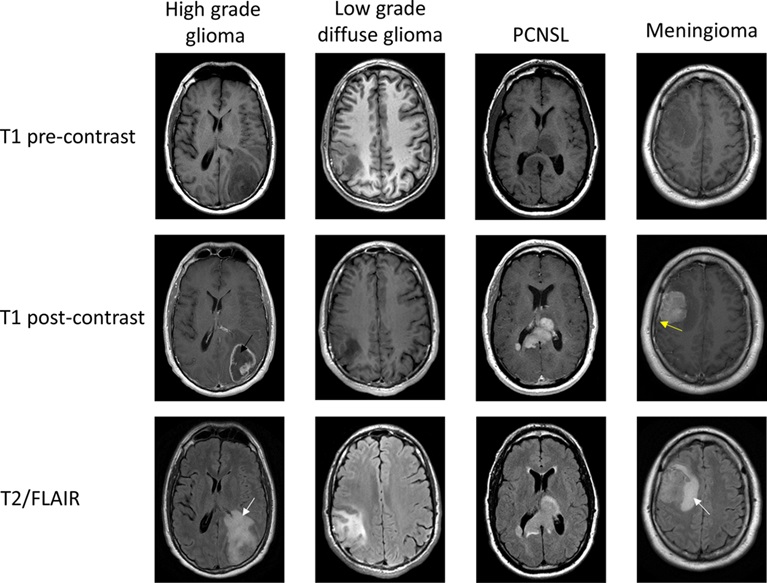
MRI là công cụ chẩn đoán hình ảnh quan trọng để chẩn đoán u não
Xét nghiệm mô bệnh học khối u là cần thiết để xác định chẩn đoán. Bệnh nhân có hình ảnh gợi ý khối u ác tính trong não nên được chuyển đến trung tâm có kỹ thuật phẫu thuật thần kinh tiên tiến. Các thủ thuật thường được thực hiện dưới gây mê toàn thân và bệnh nhân được theo dõi tại bệnh viện trong vài ngày sau phẫu thuật để phát hiện biến chứng. Việc bảo tồn chức năng thần kinh, còn gọi là phẫu thuật thần kinh bảo tồn tối đa là ưu tiên hàng đầu. Khi không thể cắt bỏ khối u, sinh thiết khối u cần được thực hiện.
Việc phân độ chính xác các khối u hệ thần kinh trung ương rất quan trọng trong việc ước tính tiên lượng của bệnh nhân và đòi hỏi phải kết hợp các đặc điểm mô bệnh học và xét nghiệm phân tử. Ví dụ, các u tế bào hình sao có đột biến gen IDH1 hoặc IDH2 và đột biến đồng hợp các gen ức chế khối u Cyclin-dependent kinase inhibitor 2A (CDKN2A và CDKN2B) được coi là u độ 4 ngay cả khi không có các đặc điểm mô bệnh học của u độ cao. Xét nghiệm phân tử cũng cần thiết để xác định các phân nhóm u thần kinh đệm có đặc điểm phân tử đặc trưng, chẳng hạn như “u thần kinh đệm lan tỏa đường giữa, thay đổi H3 K27” hoặc “u thần kinh đệm bán cầu lan tỏa, đột biến H3 G34”. Xét nghiệm phân tử cũng giúp lựa chọn phương pháp điều trị phù hợp nhất. Ví dụ, methyl hóa vùng khởi động của gen MGMT là đặc trưng của u nguyên bào thần kinh đệm có khả năng đáp ứng cao hơn với các tác nhân alkyl hóa như temozolomide. Hiện nay, nhiều trung tâm đang chuyển sang giải trình tự DNA toàn diện và phân tích methyl hóa để phân loại u não, do đó nên cân nhắc chuyển bệnh nhân đến trung tâm ung thư để thực hiện phân tích phân tử chi tiết và lên kế hoạch điều trị.
Việc phân loại giai đoạn ung thư theo hệ thống TNM thường không cần thiết trong u não vì các khối u ác tính nguyên phát phổ biến nhất của não không lan ra ngoài hệ thần kinh trung ương. Tuy nhiên, có một số ngoại lệ đáng chú ý, bao gồm:
- Bệnh nhân u lympho hệ thần kinh trung ương: cần được đánh giá toàn thân để phân biệt u lympho nguyên phát hệ thần kinh trung ương (PCNSL) với tình trạng tổn thương thứ phát của hệ thần kinh trung ương.
- Bệnh nhân u màng nội tủy (ependymoma): cần chụp MRI toàn bộ hệ thần kinh trung ương và xét nghiệm dịch não tủy sau phẫu thuật để đánh giá nguy cơ lan rộng qua màng mềm.
Điều trị triệu chứng và biến chứng
Co giật xảy ra ở khoảng 75% bệnh nhân u thần kinh đệm. Các thuốc chống động kinh không cảm ứng enzyme, như levetiracetam, lacosamide hoặc clobazam, được ưu tiên sử dụng do ít tương tác thuốc và có ít tác dụng phụ. Đối với bệnh nhân chưa từng có cơn co giật, không khuyến nghị sử dụng thuốc chống động kinh dự phòng.
Phù não được điều trị bằng corticosteroid, trong đó dexamethasone là lựa chọn ưu tiên do hoạt tính tác động thay đổi điện giải thấp và thời gian bán thải dài. Đối với các triệu chứng thần kinh nghiêm trọng như rối loạn dáng đi hoặc rối loạn ý thức, có thể dùng bolus dexamethasone. Cần sử dụng liều corticosteroid thấp nhất có thể để kiểm soát triệu chứng và giảm dần thuốc khi thích hợp. Việc giảm liều nên được thực hiện từ từ (ví dụ: giảm liều mỗi 3–4 ngày) để xác định liều tối thiểu cần thiết nhằm kiểm soát triệu chứng thần kinh và giảm nguy cơ suy thượng thận. Bệnh nhân dùng prednisone dài ngày nên được dự phòng các tác dụng phụ của corticoid, như nhiễm viêm phổi do nấm, loét dạ dày tá tràn, teo cơ do steroid,…
Huyết khối tĩnh mạch (VTE) xảy ra ở khoảng 30% bệnh nhân u thần kinh đệm và u lympho hệ thần kinh trung ương (CNS lymphoma), thường xuất hiện ngay sau phẫu thuật chẩn đoán. Bệnh nhân phẫu thuật u thần kinh nên được dự phòng bằng heparin trọng lượng phân tử thấp hoặc heparin không phân đoạn, tốt nhất là bắt đầu sau 24 giờ sau phẫu thuật. Việc sử dụng thuốc chống đông có thể làm tăng nguy cơ chảy máu nội sọ, tuy nhiên điều trị chống đông vẫn được khuyến nghị do nguy cơ tử vong cao nếu không điều trị huyết khối tĩnh mạch. Điều trị chống đông toàn thân cho huyết khối tĩnh mạch nên kéo dài ít nhất 3–6 tháng, nhưng đối với bệnh nhân u não nguyên phát, có thể cần duy trì vô thời hạn.
Bệnh nhân u não nguyên phát thường gặp suy giảm nhận thức, giảm khả năng vận động, mệt mỏi, trầm cảm, co giật và suy giảm chức năng tình dục. Quản lý triệu chứng là một phần quan trọng trong điều trị và cần cân nhắc giới thiệu sớm đến chuyên khoa chăm sóc giảm nhẹ.
Điều trị u nguyên bào thần kinh đệm
- Phẫu thuật: Loại bỏ toàn bộ khối u có tăng bắt thuốc trên hình ảnh cộng hưởng từ (MRI) có thể cải thiện thời gian sống không tiến triển bệnh và thời gian sống toàn bộ. Việc sử dụng axit 5-aminolevulinic (ALA), một tác nhân hình ảnh quang học, giúp tăng khả năng quan sát mô ác tính trong phẫu thuật, cải thiện tỷ lệ cắt bỏ toàn bộ đại thể và thời gian sống không tiến triển bệnh sau sáu tháng.
- Xạ trị và hóa trị: Trong vòng 3–6 tuần sau phẫu thuật, bệnh nhân nên được xạ trị kết hợp với hoá trị liệu temozolomide, một chất kiềm hóa dạng uống. Temozolomide được tiếp tục bốn tuần sau khi hoàn thành xạ trị, thường dùng tổng cộng sáu chu kỳ. Với bệnh nhân không thể dung nạp hóa trị kết hợp xạ trị, có thể cân nhắc điều trị xạ trị đơn thuần (nếu MGMT không bị methyl hóa) hoặc temozolomide đơn thuần (nếu MGMT bị methyl hóa).
Điều trị u thần kinh đệm IDH-mutant
- Phẫu thuật: Cắt bỏ tối đa khối u giúp kéo dài thời gian sống. Một số bệnh nhân có thể trì hoãn điều trị và chỉ theo dõi bằng MRI nếu chưa có triệu chứng.
- Xạ trị và hóa trị: Bệnh nhân có nguy cơ cao (trên 40 tuổi hoặc cắt bỏ không hoàn toàn) hưởng lợi từ kết hợp xạ trị với hóa trị theo phác đồ PCV (procarbazine, lomustine, vincristine) hoặc temozolomide. Bệnh nhân có đột biến 1p/19q hưởng lợi từ PCV với tỷ lệ kiểm soát bệnh kéo dài hơn 30% sau 20 năm.
- Điều trị đích: Các thuốc ức chế IDH-mutant và vaccine IDH1 đang được nghiên cứu.
Xạ trị là phương pháp điều trị hiệu quả khi kết hợp với các biện pháp phẫu thuật, hoá trị trong điều trị u não nguyên phát
Điều trị u lympho nguyên phát hệ thần kinh trung ương
Phẫu thuật cắt bỏ thường không giúp cải thiện tiên lượng. Hóa trị với Methotrexate liều cao (HD-MTX) là thuốc nền tảng, có thể kết hợp với cytarabine hoặc các phác đồ như R-MPV, MTR, MATRix. Sau hóa trị, có thể áp dụng ghép tế bào gốc tự thân hoặc xạ trị toàn bộ não. Trong trường hợp tái phát, nếu bệnh nhân đáp ứng với HD-MTX trước đó, có thể cân nhắc dùng lại.
Điều trị u màng não ác tính
- Theo dõi: U màng não nhỏ (<3 cm), không triệu chứng và không có phù quanh u có thể được theo dõi bằng MRI theo lịch trình: 3, 6, 12 tháng sau chẩn đoán, sau đó mỗi 6–12 tháng trong 5 năm, và mỗi 1–3 năm sau đó.
- Điều trị xạ phẫu lập thể (SRS): Với các u màng não không triệu chứng nhưng không thể phẫu thuật do vị trí khó, xạ phẫu lập thể có thể kiểm soát kích thước khối u ở 98,2% bệnh nhân và làm giảm kích thước (≥25%) ở 35,5% bệnh nhân.
- Phẫu thuật: Đối với các u lớn, phát triển nhanh, có triệu chứng hoặc xâm lấn nhu mô não, phẫu thuật cắt bỏ hoàn toàn (nếu có thể) là yếu tố tiên lượng sống quan trọng nhất.
- Xạ trị hỗ trợ: Tất cả các trường hợp u màng não độ 3 và các u màng não độ 2 cắt bỏ không hoàn toàn đều cần xạ trị hỗ trợ. Khi tái phát (tỷ lệ 50–90% đối với u độ 2 và 3), có thể cân nhắc phẫu thuật lại hoặc xạ trị bổ sung.
Điều trị U màng nội tủy ác tính (Malignant Ependymomas)
- Phẫu thuật: Là phương pháp điều trị hàng đầu. Cắt bỏ toàn bộ u có liên quan đến cải thiện thời gian sống.
- Xạ trị: Được khuyến cáo sau phẫu thuật cho u màng nội tủy độ 3 và u độ 2 chưa cắt bỏ hoàn toàn. Nếu u đã lan đến tủy sống hoặc dịch não tủy, cần xạ trị toàn bộ trục não-tủy.
- Hóa trị: Không phải là điều trị tiêu chuẩn do không mang lại lợi ích rõ ràng trong các nghiên cứu hồi cứu.
U não nguyên phát là một nhóm bệnh lý đa dạng và phức tạp, việc chẩn đoán không chỉ dựa vào hình ảnh mà còn cần đến sinh thiết mô bệnh học, xét nghiệm di truyền phân tử để xác định chính xác loại u và lựa chọn phương pháp điều trị phù hợp. Hiện nay, các phương pháp điều trị bao gồm phẫu thuật, xạ trị, hóa trị, liệu pháp nhắm trúng đích và miễn dịch, trong đó nhiều tiến bộ đang mở ra hy vọng cải thiện tiên lượng cho bệnh nhân. Các nghiên cứu đang tiếp tục khám phá các liệu pháp mới, hứa hẹn sẽ mang đến những bước đột phá trong điều trị u não nguyên phát trong tương lai.
Quý khách hàng vui lòng lựa chọn dịch vụ y tế theo nhu cầu!
