Bác sĩ: ThS.BSNT Trần Hiền
Chuyên khoa:
Năm kinh nghiệm:
Viêm cơ (myositis) là nhóm bệnh viêm tự miễn đặc hiệu (idiopathic inflammatory myopathies), bao gồm bốn thể chính: viêm da cơ (dermatomyositis - DM), viêm đa cơ (polymyositis - PM), bệnh cơ hoại tử (necrotizing myopathy - NM) và viêm cơ thể vùi (inclusion body myositis - IBM). Các bệnh này đặc trưng bởi tình trạng yếu cơ, với các biểu hiện lâm sàng và cơ chế bệnh sinh riêng biệt. Viêm cơ là bệnh hiếm gặp, ảnh hưởng đến chất lượng cuộc sống và có thể gây biến chứng nghiêm trọng nếu không được chẩn đoán và điều trị kịp thời.
Chẩn đoán viêm cơ dựa trên khám lâm sàng, xét nghiệm máu, điện cơ (EMG), hình ảnh học (MRI) và sinh thiết cơ. Mặc dù các phương pháp chẩn đoán đã có nhiều tiến bộ, đặc biệt với việc phát hiện kháng thể đặc hiệu cho viêm cơ (myositis-specific autoantibodies - MSA), điều trị vẫn còn nhiều thách thức do thiếu các thử nghiệm lâm sàng đối chứng. Viêm da cơ, viêm đa cơ và bệnh cơ hoại tử thường đáp ứng với liệu pháp ức chế miễn dịch, trong khi viêm cơ thể vùi thường kháng trị, đòi hỏi các chiến lược quản lý riêng biệt. Bài viết này cung cấp cái nhìn toàn diện về cơ chế bệnh sinh, chẩn đoán và điều trị viêm cơ, dựa trên các tiến bộ nghiên cứu gần đây.
3.1. Viêm da cơ (DM)
Cơ chế bệnh sinh của viêm da cơ liên quan đến tổn thương vi mạch do phức hợp miễn dịch gắn vào tế bào nội mô, kích hoạt hệ bổ thể và hình thành phức hợp tấn công màng (membrane-attack complex - MAC), gây ly giải tế bào và giảm số lượng mao mạch cơ. Điều này dẫn đến thiếu máu cục bộ và teo cơ quanh bó. Gần đây, vai trò của interferon loại I (IFN-α/β) được nhấn mạnh, với sự biểu hiện quá mức của các gen liên quan IFN trong cơ, da và máu, tương quan với mức độ hoạt động bệnh. Tế bào tua (dendritic cells) được xem là nguồn sản xuất IFN và đóng vai trò trình diện kháng nguyên. Các cytokine viêm như TGF-β, IL-1β, CCL-3, CCL-4 và các phân tử bám dính (VCAM-1, ICAM-1) cũng tăng biểu hiện, thúc đẩy sự xâm nhập của tế bào miễn dịch (T, B, đại thực bào, tế bào tua plasmacytoid) vào mô cơ và da. Ở da, tổn thương bao gồm thoái hóa chân không của tế bào nền biểu bì, teo biểu bì và viêm da với sự lắng đọng MAC dọc ranh giới da-biểu bì.
3.2. Viêm đa cơ (PM)
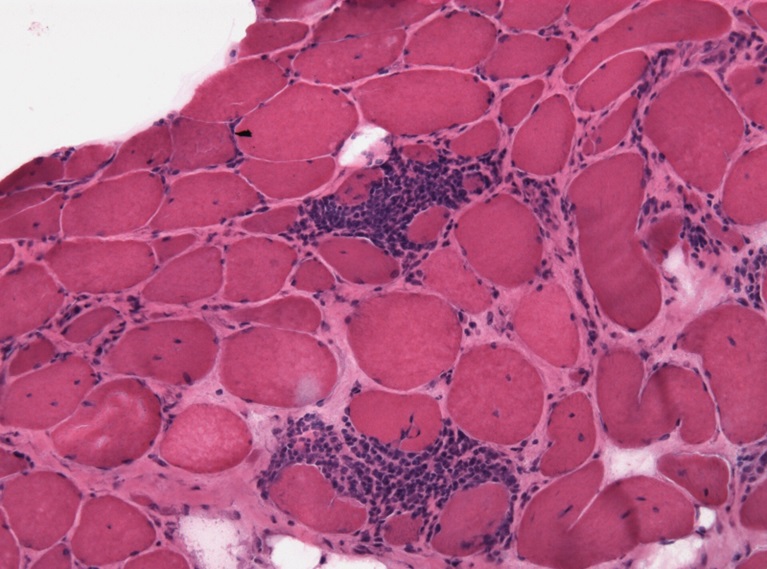
Viêm đa cơ - thâm nhiễm viêm trong sinh thiết cơ
Viêm đa cơ đặc trưng bởi sự kích hoạt cục bộ của tế bào miễn dịch trong cơ xương, với sự xâm nhập của đại thực bào và tế bào T CD8+ độc tế bào, bao quanh hoặc xâm nhập vào sợi cơ không hoại tử. Môi trường viêm cục bộ bao gồm các cytokine như IFN-γ, IL-6, IL-1β, TNF-α, TGF-β và chemokine (IL-8, CCL-2, CCL-3, CCL-4, CCL-5, CXCL-9, CXCL-10), thu hút tế bào miễn dịch. Sự di chuyển của tế bào miễn dịch được hỗ trợ bởi các phân tử bám dính (ICAM-1, VCAM-1) và thụ thể (VLA-4, LFA-1). Metalloproteinase 2 và 9, được tiết ra bởi tế bào viêm, phân giải ma trận ngoại bào, hỗ trợ di chuyển tế bào T. MHC-I, được tăng biểu hiện trên sợi cơ trong điều kiện viêm, đóng vai trò trung tâm trong tương tác giữa sợi cơ và tế bào miễn dịch.
3.3. Bệnh cơ hoại tử (NM)
Cơ chế bệnh sinh của bệnh cơ hoại tử vẫn chưa được hiểu rõ hoàn toàn. Sinh thiết cơ cho thấy các sợi cơ hoại tử rải rác, với ít tế bào viêm (chủ yếu là đại thực bào, một số tế bào T CD4+ và CD8+). Kháng thể chống SRP hoặc HMGCR liên quan đến khoảng 60% trường hợp, gợi ý vai trò tự miễn. Statin, được sử dụng ở 2/3 bệnh nhân có kháng thể HMGCR, có thể gây độc cơ, làm tăng nguy cơ bệnh cơ hoại tử. Biểu hiện MHC-I trên sợi cơ hoại tử hoặc tái sinh không đặc hiệu, và tương tác giữa tế bào miễn dịch được cho là đóng vai trò trong tiến triển bệnh.
3.4. Viêm cơ thể vùi (IBM)
Viêm cơ thể vùi có cơ chế bệnh sinh phức tạp, kết hợp cả viêm và thoái hóa. Quá trình viêm tương tự viêm đa cơ, với sự xâm nhập của đại thực bào và tế bào T CD8+ vào sợi cơ không hoại tử, cùng biểu hiện quá mức của cytokine, chemokine và metalloproteinase 2, 9. Thành phần thoái hóa bao gồm các thể vùi viền (rimmed vacuoles) và lắng đọng β-amyloid, p-tau, presenilin 1, apolipoprotein, α-synuclein và các protein liên quan đến thoái hóa thần kinh khác. Căng thẳng tế bào, với sự đồng định vị của αB-crystallin và β-amyloid, là yếu tố quan trọng. Quá trình tự thực bào (macroautophagy) bất thường góp phần tích lũy protein sai lệch, đặc biệt trong môi trường viêm. Nitric oxide synthase cảm ứng (iNOS) tăng biểu hiện trong điều kiện viêm, gây chết sợi cơ.
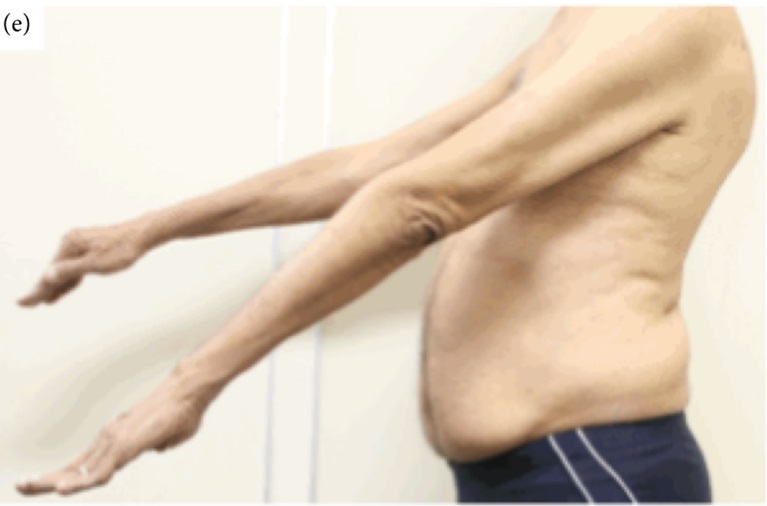
Teo cơ chi trên ở người mắc viêm cơ thể vùi
3.5. Các hội chứng chồng lấn và viêm cơ khu trú
Hội chứng chồng lấn kết hợp viêm da cơ/ viêm đa cơ với các bệnh tự miễn khác như viêm khớp dạng thấp, xơ cứng bì, lupus ban đỏ hệ thống hoặc hội chứng Sjögren, thường kèm kháng thể đặc hiệu như Jo-1, PM/SCL, U1RNP. Viêm cơ khu trú chỉ ảnh hưởng đến một hoặc vài cơ (cánh tay, chân, mắt), liên quan đến các bệnh như sarcoidosis, lupus hoặc viêm mạch ANCA. Các trường hợp này có thể đáp ứng với corticosteroid hoặc ức chế miễn dịch.
2.1. Viêm da cơ (DM)
Viêm da cơ có tỷ lệ mắc khoảng 1,4/100.000 dân và tỷ lệ lưu hành 5,8/100.000 dân tại Hoa Kỳ, với nữ giới chiếm ưu thế và thường gặp ở người lớn tuổi. Ở trẻ em, bệnh được gọi là viêm da cơ vị thành niên (JDM), với tỷ lệ lưu hành khoảng 3,2/1 triệu trẻ em tại Anh, phổ biến hơn ở bé gái.
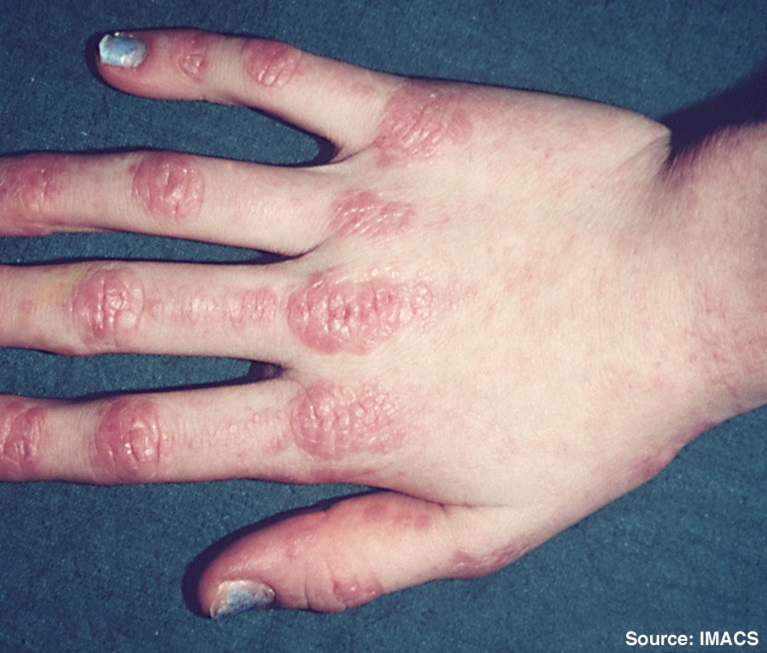
Các vùng đỏ khu trú nằm trên các khớp ngón tay ở một người mắc viêm da cơ, được gọi là các sẩn Gottron
Bệnh nhân viêm da cơ biểu hiện yếu cơ đối xứng ở cơ gốc chi, phát triển trong vài tuần đến vài tháng, kèm theo tổn thương da đặc trưng như phát ban (màu tím quanh mí mắt), phù mí mắt, dấu hiệu "bàn tay thợ máy" (da thô ráp ở lòng bàn tay), nốt sẩn ở mặt duỗi khớp và vôi hóa dưới da. Đau cơ không điển hình nhưng có thể xảy ra. Các biến chứng nghiêm trọng bao gồm khó nuốt, bệnh phổi kẽ và nguy cơ ung thư. Một thể đặc biệt là viêm da cơ không yếu cơ (clinically amyopathic DM - CADM), chiếm khoảng 20% trường hợp, với tổn thương da điển hình nhưng không hoặc chỉ có yếu cơ nhẹ.
2.2. Viêm đa cơ (PM)
Viêm đa cơ có tỷ lệ mắc 3,8/100.000 dân và tỷ lệ lưu hành 9,7/100.000 dân tại Hoa Kỳ. Bệnh đặc trưng bởi yếu cơ đối xứng ở cơ gốc chi, chủ yếu ở vùng vai và chậu, thường khởi phát bán cấp, kèm tăng creatine kinase (CK) đáng kể. Các cơ gấp cổ thường bị ảnh hưởng, đôi khi cả cơ duỗi cổ. Viêm đa cơ thường bị chẩn đoán quá mức do thiếu sinh thiết cơ xác định, vì các bệnh lý cơ khác có thể có biểu hiện tương tự.
2.3. Bệnh cơ hoại tử (NM)
Bệnh cơ hoại tử, còn gọi là bệnh cơ hoại tử tự miễn (immune-mediated necrotizing myopathy), biểu hiện yếu cơ đối xứng ở cơ gốc chi, tương tự viêm đa cơ, với đau cơ ở khoảng 80% bệnh nhân. Trong các trường hợp nặng, bệnh nhân có thể khó nuốt hoặc khó phát âm. Bệnh cơ hoại tử là một nhóm bệnh không đồng nhất, liên quan đến cơ chế tự miễn, hội chứng cận u, tiếp xúc với độc tố hoặc thuốc (như statin). Kháng thể chống signal recognition particle (SRP) hoặc 3-hydroxy-3-methylglutaryl co-enzyme A reductase (HMGCR) được phát hiện ở khoảng 60% bệnh nhân bệnh cơ hoại tử. Bệnh thường gặp ở nam giới (61%) với độ tuổi khởi phát trung bình ở lứa tuổi 50 (liên quan SRP) hoặc 60 (liên quan HMGCR).
2.4. Viêm cơ thể vùi (IBM)
Viêm cơ thể vùi là bệnh cơ phổ biến nhất ở người trên 50 tuổi, với tỷ lệ lưu hành khoảng 9,3/1 triệu dân tại Úc, tăng lên 51,3/1 triệu ở nhóm trên 50 tuổi, với nam giới chiếm ưu thế. Bệnh tiến triển chậm, không đau, gây yếu cơ không đối xứng, đặc biệt ở cơ gấp ngón tay, cơ duỗi đầu gối và khó nuốt (65-80% bệnh nhân). Bệnh nhân thường cần thiết bị hỗ trợ đi lại sau 14 -16 năm và phụ thuộc xe lăn hoàn toàn sau khoảng 24 năm. Mặc dù gây tàn phế nặng, tuổi thọ của bệnh nhân IBM không giảm.
Chẩn đoán viêm cơ đòi hỏi tiếp cận đa phương thức, kết hợp bệnh sử, khám lâm sàng, xét nghiệm, chẩn đoán hình ảnh và sinh thiết cơ.
4.1. Bệnh sử và khám lâm sàng
4.2. Xét nghiệm
4.3. Điện cơ (EMG)
EMG cho thấy mô hình cơ bệnh ở cơ bị ảnh hưởng, với dấu hiệu tổn thương cấp tính (sóng sắc nhọn, phức hợp phóng điện tự phát). Nghiên cứu tại Hà Lan cho thấy không có bệnh nhân viêm da cơ, viêm đa cơ hoặc viêm cơ thể vùi nào có EMG bình thường.
4.4. Chẩn đoán hình ảnh
4.5. Sinh thiết cơ
Sinh thiết cơ là tiêu chuẩn vàng để phân biệt các thể viêm cơ:
4.6. Đánh giá biến chứng
Điều trị viêm da cơ, viêm đa cơ và bệnh cơ hoại tử
Điều trị viêm da cơ, viêm đa cơ và bệnh cơ hoại tử chủ yếu dựa trên các liệu pháp ức chế miễn dịch nhằm cải thiện sức cơ, kiểm soát tình trạng viêm và giảm thiểu biến chứng. Liệu pháp corticosteroid được sử dụng khởi đầu với prednisolone truyền tĩnh mạch liều 250-1000 mg mỗi ngày trong 3-5 ngày, sau đó chuyển sang prednisone uống liều 1 mg/kg mỗi ngày trong ít nhất 4 tuần. Khi bệnh ổn định, thường sau 4-12 tuần, liều prednisone được giảm dần mỗi 1-2 tuần, tùy thuộc vào đáp ứng lâm sàng. Tác dụng phụ của corticosteroid bao gồm loãng xương, cần bổ sung calcium 1000 mg và vitamin D 500 IU mỗi ngày, và bệnh cơ do steroid, gây yếu cơ gốc chi tiến triển chậm, có thể phân biệt với tái phát bệnh qua điện cơ.
Các thuốc ức chế miễn dịch thường được phối hợp để giảm liều corticosteroid. Methotrexate thường được dùng kết hợp với leucoverin hoặc folic acid để giảm độc tính, nhưng có thể gây tăng men gan, đòi hỏi theo dõi máu định kỳ. Azathioprine khởi đầu liều 50 mg mỗi ngày, tăng dần đến khi số lượng lympho đạt 600-1000/μl, cần kiểm tra enzym thiopurine methyltransferase trước điều trị để tránh ức chế tủy xương. Mycophenolate mofetil ít tác dụng phụ hơn methotrexate và azathioprine, nhưng vẫn có nguy cơ độc gan và thận. Cyclosporin ít được sử dụng do độc tính cao trên gan và thận. Dù thiếu thử nghiệm đối chứng, đồng thuận quốc tế khuyến cáo sử dụng các thuốc này để hỗ trợ điều trị.
Immunoglobulin tĩnh mạch được chỉ định khi bệnh nhân không đáp ứng hoặc gặp tác dụng phụ với thuốc ức chế miễn dịch, tái phát bệnh, hoặc ở phụ nữ mang thai và trẻ vị thành niên. Hiệu quả cải thiện sức cơ được xác nhận qua thử nghiệm đối chứng, đặc biệt ở viêm da cơ và viêm đa cơ. Tác dụng phụ bao gồm nguy cơ huyết khối, sốt và phản ứng dị ứng, cần kiểm tra tình trạng thiếu immunoglobulin A trước điều trị.
Kháng thể đơn dòng cũng được sử dụng trong một số trường hợp. Rituximab, với cơ chế gây suy giảm tế bào B, cho thấy hiệu quả giảm liều corticosteroid và cải thiện triệu chứng ở 83% bệnh nhân kháng trị. Etanercept, một chất ức chế TNF-α, hỗ trợ giảm liều corticosteroid ở viêm da cơ nhưng không cải thiện sức cơ. Cyclophosphamide được dùng trong các trường hợp kháng trị nặng, nhưng nguy cơ tác dụng phụ cao nên cần hạn chế sử dụng. Vật lý trị liệu định kỳ hai lần mỗi tuần và chương trình tập luyện tại nhà là yếu tố quan trọng, giúp cải thiện sức cơ và chức năng vận động ở bệnh nhân viêm da cơ, viêm đa cơ và bệnh cơ hoại tử.
Rituximab, kháng thể đơn dòng điều trị viêm cơ tự miễn
Điều trị viêm cơ thể vùi
Điều trị viêm cơ thể vùi là thách thức lớn do bệnh kháng với các liệu pháp ức chế miễn dịch, có thể do cơ chế thoái hóa vượt trội hơn quá trình viêm. Prednisone thường không hiệu quả, dù một số bệnh nhân có cải thiện tạm thời, nhưng nghiên cứu cho thấy điều trị ức chế miễn dịch có thể làm bệnh tiến triển nhanh hơn. Immunoglobulin tĩnh mạch không cải thiện sức cơ chi nhưng hiệu quả trong điều trị khó nuốt ở viêm cơ thể vùi, viêm da cơ và viêm đa cơ. Alemtuzumab, một kháng thể đơn dòng, giảm tiến triển bệnh trong 6 tháng theo một nghiên cứu, nhưng nguy cơ gây bệnh tự miễn như viêm tuyến giáp hoặc giảm tiểu cầu. Các thuốc thử nghiệm như simvastatin, lithium, arimoclomol, BYM338/bimagrumab và liệu pháp gen follistatin chưa mang lại hiệu quả rõ ràng. Vật lý trị liệu, đặc biệt với chương trình tập luyện tại nhà giúp cải thiện đáng kể sức cơ ở các nhóm cơ bị ảnh hưởng, trở thành thành phần thiết yếu trong quản lý viêm cơ thể vùi.
Điều trị khó nuốt
Khó nuốt là biến chứng phổ biến, đặc biệt ở viêm cơ thể vùi với tỷ lệ 65-80%, làm tăng nguy cơ suy dinh dưỡng và viêm phổi hít. Immunoglobulin tĩnh mạch cải thiện chức năng nuốt ở viêm cơ thể vùi, viêm da cơ và viêm đa cơ, với 82% bệnh nhân trở lại ăn uống qua đường miệng. Các can thiệp xâm lấn như cắt cơ vòng họng, giãn hầu-thực quản, đặt ống thông dạ dày qua da hoặc tiêm botulinum toxin chỉ mang lại kết quả hạn chế, kèm nguy cơ biến chứng như viêm phổi hít. Cắt cơ vòng họng không được khuyến cáo nếu cơ vòng thực quản trên hoạt động bình thường. Đánh giá nuốt qua nội soi giúp xác định cơ chế khó nuốt, từ đó định hướng điều trị phù hợp.
Biến chứng và tiên lượng
Bệnh phổi kẽ là biến chứng phổ biến ở viêm da cơ, viêm đa cơ (đặc biệt trong các trường hợp có kháng thể chống synthetase hoặc anti-CADM). Tình trạng này có thể tiến triển nhanh và gây suy hô hấp, vì vậy chụp cắt lớp vi tính phổi độ phân giải cao là công cụ quan trọng giúp phát hiện sớm tổn thương.
Ung thư là biến chứng cần lưu ý ở bệnh nhân viêm da cơ và viêm đa cơ. Khoảng 24% bệnh nhân viêm da cơ có liên quan đến ung thư, trong khi tỷ lệ này ở viêm đa cơ là khoảng 10%. Viêm cơ hoại tử thường liên quan đến các loại ung thư tiêu hóa, ung thư phổi hoặc ung thư vú. Do đó, việc sàng lọc ung thư định kỳ là cần thiết trong quá trình theo dõi bệnh.
Tổn thương tim mạch cũng có thể xảy ra ở bệnh nhân viêm da cơ và viêm đa cơ, bao gồm viêm cơ tim, rối loạn van tim, thiếu máu cơ tim hoặc suy tim. Cần theo dõi điện tâm đồ và siêu âm tim để phát hiện sớm các biến chứng này.
Khó nuốt là biểu hiện thường gặp ở người bệnh, đặc biệt trong viêm cơ thể vùi. Tình trạng này làm tăng nguy cơ viêm phổi do hít và suy dinh dưỡng nếu không được kiểm soát tốt.
Tiên lượng của các thể bệnh viêm cơ phụ thuộc vào nhiều yếu tố. Trong đó, viêm da cơ, viêm đa cơ và viêm cơ hoại tử thường có tiên lượng tốt nếu được điều trị sớm. Tuy nhiên, sự xuất hiện của bệnh phổi kẽ, ung thư hoặc tổn thương tim có thể làm tiên lượng xấu đi. Viêm cơ thể vùi là thể bệnh tiến triển chậm, gây tàn phế đáng kể nhưng thường không ảnh hưởng đến tuổi thọ.
Viêm cơ là một nhóm bệnh tự miễn phức tạp, bao gồm bốn thể bệnh chính: viêm da cơ, viêm đa cơ, viêm cơ hoại tử và viêm cơ thể vùi. Mỗi thể bệnh có những đặc điểm lâm sàng và cơ chế bệnh sinh riêng biệt. Việc chẩn đoán dựa trên sự kết hợp giữa thăm khám lâm sàng, xét nghiệm tìm kháng thể đặc hiệu, điện cơ, cộng hưởng từ và sinh thiết cơ. Trong đó, sinh thiết cơ là tiêu chuẩn vàng giúp phân biệt rõ các thể bệnh khác nhau.
Những tiến bộ gần đây trong nghiên cứu, đặc biệt trong việc phát hiện các kháng thể đặc hiệu và hiểu rõ hơn về cơ chế sinh bệnh, đang mở ra nhiều triển vọng trong việc phát triển các liệu pháp điều trị mới. Quản lý viêm cơ hiệu quả cần sự phối hợp của nhiều chuyên khoa như thần kinh, miễn dịch học, phục hồi chức năng và dinh dưỡng, nhằm cải thiện chất lượng sống, hạn chế biến chứng và hỗ trợ bệnh nhân trong việc duy trì hoạt động thường ngày.
Quý khách hàng vui lòng lựa chọn dịch vụ y tế theo nhu cầu!
